ReproFF2

【特徴】
・培養作業は月・水・金のみ! ・培地使用量が約半分 ・オンフィーダー培養と同様、未分化維持が良好 ・オンフィーダー培養と同様、分化能も維持注1)bFGFは含まれておりませんので、ヒトES細胞、ヒトiPS細胞培養時は添加してください。
※保存温度:-20℃以下
製品コンセプト:土日の培養作業は不要!
■ 概要
■ データ
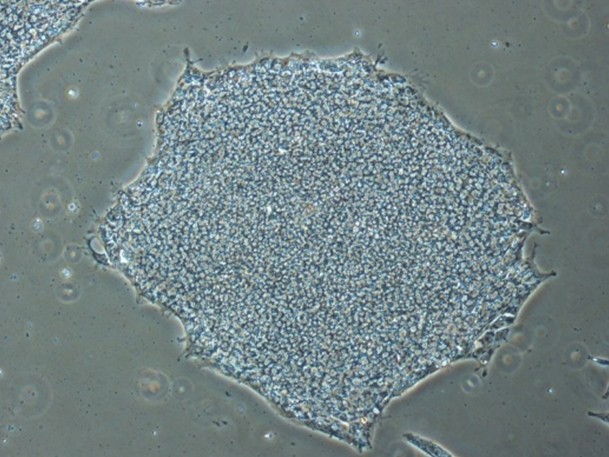
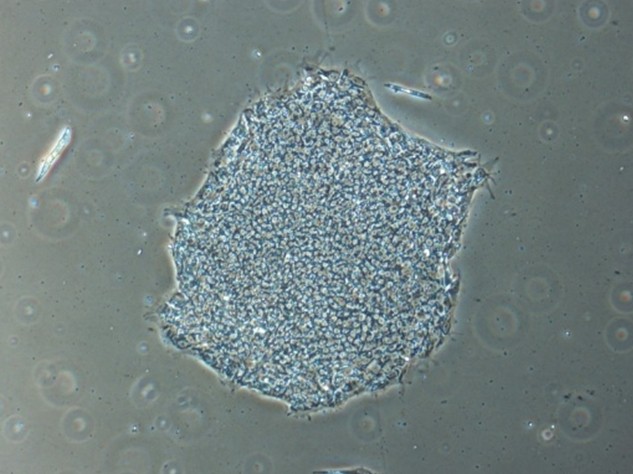
ReproFF2を用いたフィーダーレス環境下でのヒトES細胞/iPS細胞の未分化維持培養
オンフィーダー培養同様に、未分化を良好に維持できます。
ヒトiPS細胞の未分化維持培養
ヒトiPS細胞201B7株を使用 ReproFF2(フィーダーレス)培養: Passage 10, day 7 オンフィーダー培養: Passage 48, day 3
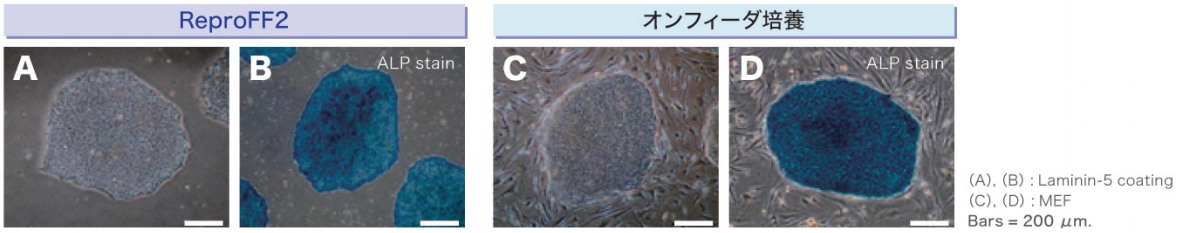
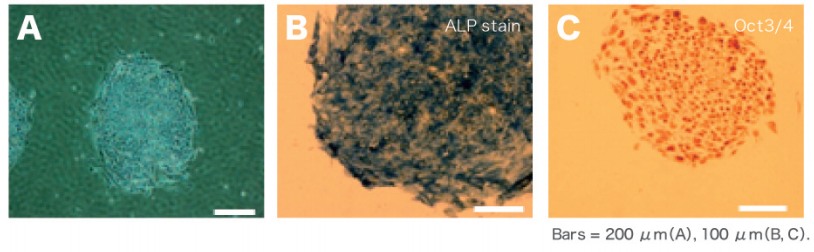
1. コロニーの形態とアルカリフォスファターゼ活性の確認
ReproFF2でフィーダーレス培養されたヒトiPS細胞は、オンフィーダー培養された細胞同様のコロニー形態とアルカリフォスファターゼ活性陽性を示しました。
ReproFF2に移行後、細胞の状態が悪くなる場合がありますが、継代を続けると状態が安定します。 詳細はこちらを御覧ください。
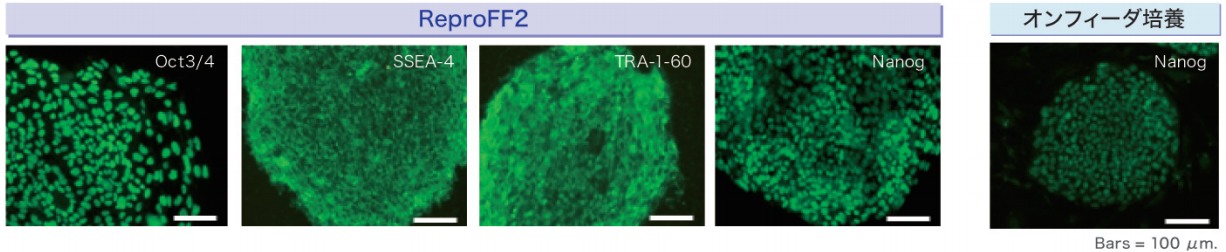
2. 未分化マーカーの免疫染色結果
ReproFF2でフィーダーレス培養されたヒトiPS細胞はオンフィーダー細胞と同様Oct3/4, Nanog, SSEA-1, TRA-1-60を発現している事が確認されました。

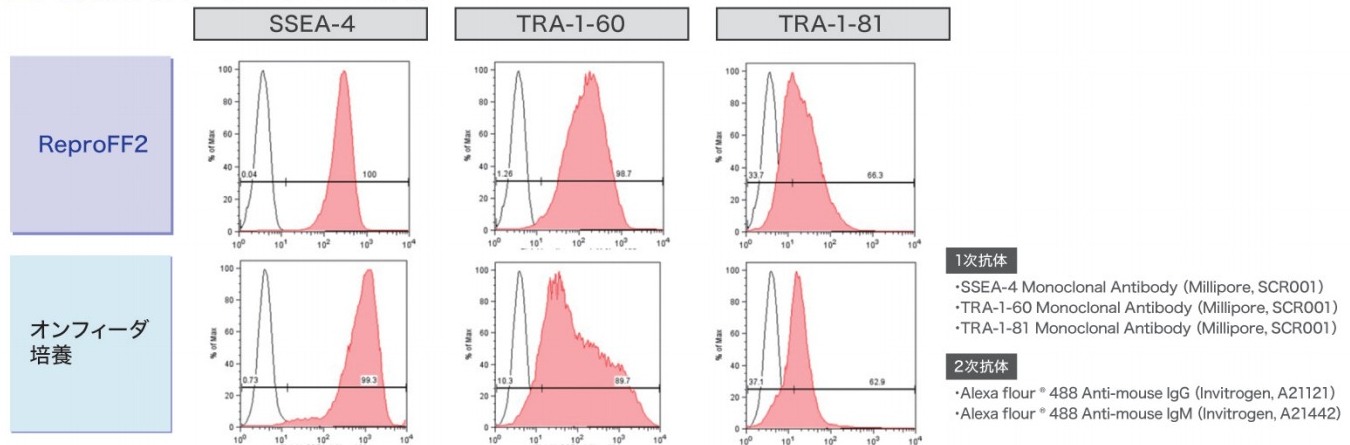
3. 未分化マーカーのFACS解析
ReproFF2でフィーダーレス培養されたヒトiPS細胞は、オンフィーダー培養同様の陽性率を示しました。
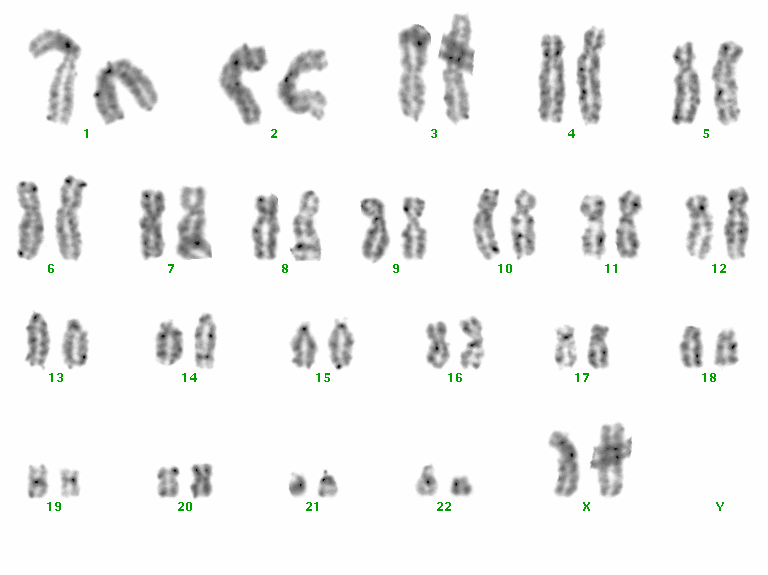
4. 長期培養時の核型の安定性
5. ヒトES細胞の未分化維持培養
ヒトES細胞KhES-1株を使用
京都大学再生医科学研究所付属幹細胞医学研究センターのご協力により、同研究所で樹立されたヒトES細胞株(KhES-1)を用いて、ReproFF2の培養評価を行っていただきました。
ReproFF2でフィーダーレス培養されたヒトES細胞はアルカリフォスファターゼ染色陽性、Oct3/4陽性を示し、未分化性が良好に維持されている事が確認されました。
 モニターユーザー様による各種ヒトiPS細胞株での培養実績も公開しておりますので御覧ください。
モニターユーザー様による各種ヒトiPS細胞株での培養実績も公開しておりますので御覧ください。
ReproFF2を用いたヒトiPS細胞の培養において状態の悪いコロニーが見られる場合の例
ReproFF2はヒトES/iPS細胞の安定した未分化維持培養に適した培地ですが、培養操作や状況によっては、一時的にコロニーの状態が悪くなる場合がございます。 以下のような場合は問題ございませんので、注意書きに従って安心して培養を継続してください。 また、培養細胞の状態に関して不安がある場合は弊社までお気軽にご相談ください。 培養状態改善のためのアドバイスをさせて頂きます。
ReproFF2に移行直後のコロニーの様子
ReproFF2に移行後、細胞の状態が悪くなる場合があります (下図:左側)。 継代を続けていただくと状態が安定してまいります (下図:右側) ので、4継代程度培養を続けてください。 (クリックすると画像を拡大できます)
ReproFF2を用いた継代後の様子 (継代時のコロニーサイズが小さすぎる場合)
継代後、下図左側の写真のような細胞が見られる場合は、継代時のコロニーが小さすぎる可能性があります。 継代時の操作においてピペッティングの回数を減らす、またはピペッティングの強さを弱くしてください。 (クリックすると画像を拡大できます)
ReproFF2でフィーダーレス培養されたヒトiPS細胞の分化能
ReproFF2で培養したヒトiPS細胞はオンフィーダー培養細胞と同様に、心筋や神経への分化能を示しました。
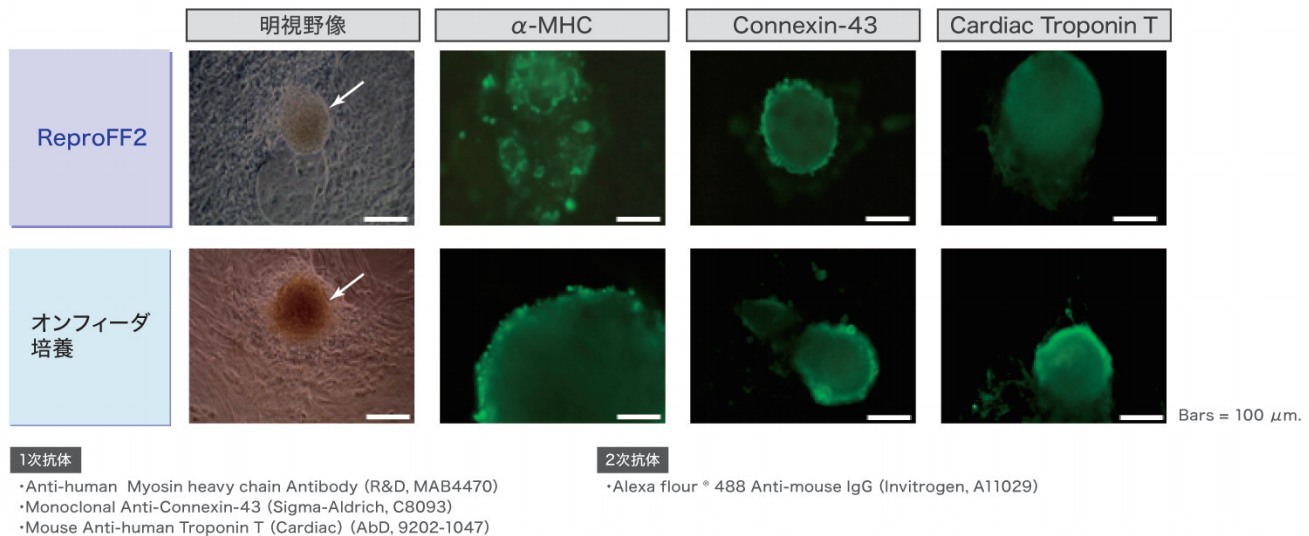
ヒトiPS細胞から心筋細胞への分化
ReproFF2でフィーダーレス培養されたヒトiPS細胞から心筋細胞へと分化誘導を行った結果、心筋マーカー発現陽性の拍動心筋細胞塊が認められました。
この結果より、ReproFF2でフィーダーレス培養されたヒトiPS細胞は、オンフィーダー培養と同様に、心筋細胞への分化能を有している事が確認されました。
※α-MHC, Connexin-43, Cardiac Troponin T: 心筋マーカー
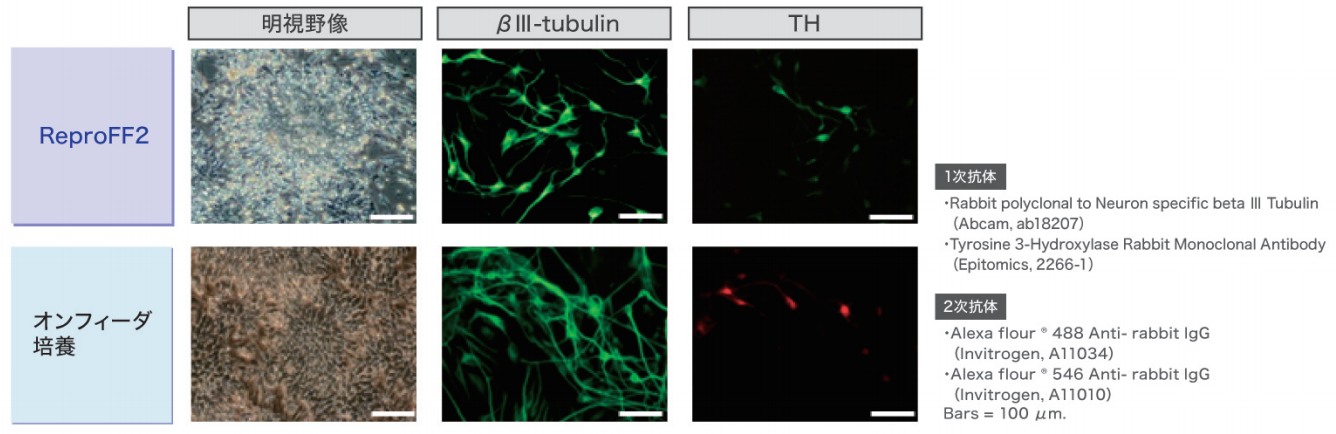
ヒトiPS細胞から神経前駆細胞・神経細胞への分化
ReproFF2でフィーダーレス培養されたヒトiPS細胞から神経細胞へと分化誘導を行った結果、ロゼッタの形成を経てβIII-tubulinおよびTH陽性の神経細胞が認められました。
この結果より、ReproFF2でフィーダーレス培養されたヒトiPS細胞はオンフィーダー培養された細胞と同様に、神経細胞への分化能を有している事が確認されました。
※ロゼッタ:神経前駆細胞のマーカーとなる形態的特徴 ※βIII-tubulin:神経線維のマーカー ※TH (Tyrosine 3-Hydroxyrase):ドーパミン作動性神経細胞のマーカー
製品リスト・価格
| 品番 | 製品名 |
|---|---|
| RCHEMD006 | ReproFF2(500 mL) |
| RCHEMD006A | ReproFF2(500 mL)x3 |
| RCHEMD006B | ReproFF2(500 mL)x3 & bFGF(25 μL) Pack |
プロトコル
ReproFF2 (オンフィーダー培養からの切り替え/フィーダーレス培養からの切り替え) プロトコル
リプロセル Dissociation Solution (RCHETP002) とLaminin-5 (RCHEOT004) またはヒトES細胞用マトリゲル (Corning) を使ったプロトコル ReproFF2 (オンフィーダー培養からの切り替え) プロトコル ReproFF2 (フィダーレス培養からの切り替え) プロトコルデータシート
製品安全データシート
論文・発表
- Morizane R, et al. “Nephron organoids derived from human pluripotent stem cells model kidney development and injury.” Nat Biotechnol. 2015 Oct 12. doi: 10.1038/nbt.3392.
- Naoki Nishishita, et al. “Generation and Maintenance of iPSCs From CD34+Cord Blood Cells on Artificial Cell Attachment Substrate.” Biochemistry, Genetics and Molecular Biology, Chapter 5.
- Kanemura, Hoshimi, et al. “Tumorigenicity Studies of Induced Pluripotent Stem Cell (iPSC)-Derived Retinal Pigment Epithelium (RPE) for the Treatment of Age-Related Macular Degeneration.” PloS one 9.1 (2014): e85336.
- Hasegawa, Tsuyoshi, et al. “Cancer‐associated fibroblasts might sustain the stemness of scirrhous gastric cancer cells via transforming growth factor‐β signaling.” International Journal of Cancer (2013).
- Kanemura, Hoshimi, et al. “Pigment epithelium-derived factor secreted from retinal pigment epithelium facilitates apoptotic cell death of iPSC.” Scientific reports 3 (2013).
- Lam, Albert Q., et al. “Rapid and Efficient Differentiation of Human Pluripotent Stem Cells into Intermediate Mesoderm That Forms Tubules Expressing Kidney Proximal Tubular Markers.” Journal of the American Society of Nephrology: JASN (2013).
- Murakami, Masashi, et al. “The use of granulocyte-colony stimulating factor induced mobilization for isolation of dental pulp stem cells with high regenerative potential.” Biomaterials 34.36 (2013): 9036-9047.
- Nishishita, Naoki, et al. “Generation of virus-free induced pluripotent stem cell clones on a synthetic matrix via a single cell subcloning in the naive state.” PloS one 7.6 (2012): e38389.
- Sugiyama, Norikazu, et al. “Label-free characterization of living human induced pluripotent stem cells by subcellular topographic imaging technique using full-field quantitative phase microscopy coupled with interference reflection microscopy.” Biomedical optics express 3.9 (2012): 2175-2183.