|
|
iPS細胞ゲノム編集受託サービス(CRISPR/Cas9)
|
|

従来の手法では困難であった高度な遺伝子編集サービスを提供します
CRISPR/Cas9技術基本特許の商用ライセンスを受けています

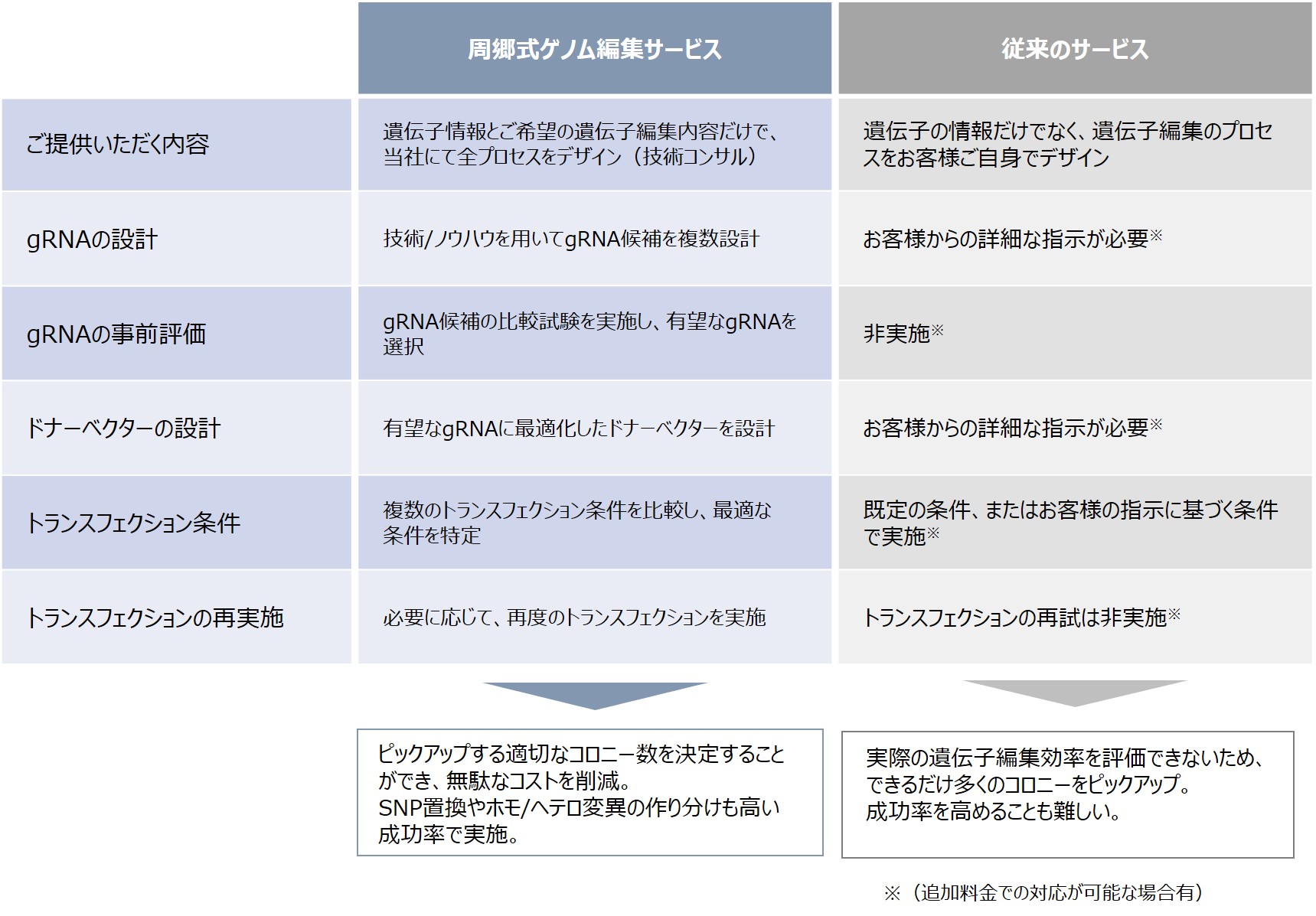
1)リプロセル社ゲノム編集サービスの優位性
武田薬品工業からスピンアウトしたGenAhead Bio社との協業により画期的なゲノム編集サービスを提供しております。本サービスは、同社社長の周郷氏により開発された新規技術(CRISPR-SNIPER)を用いており、従来のサービスと比較して、一塩基置換やホモ/ヘテロ変異の作り分けなど、難易度の高い遺伝子編集を高い成功確率で提供いたします。 我々のこれまでの経験から最適と考えられるゲノム編集デザイン(gRNA/ドナーベクターの設計)を提案いたしますので、お客様はご要望(ターゲットの遺伝子や編集内容)を、当社に伝えていただくだけで、目的の細胞が得られます。自施設で成功しなかったプロジェクトや、アイデア段階でも構いませんので、お気軽にご相談ください。
GenAhead Bio社は、CRISPR/Cas9の基本特許の商用ライセンスを取得しています。
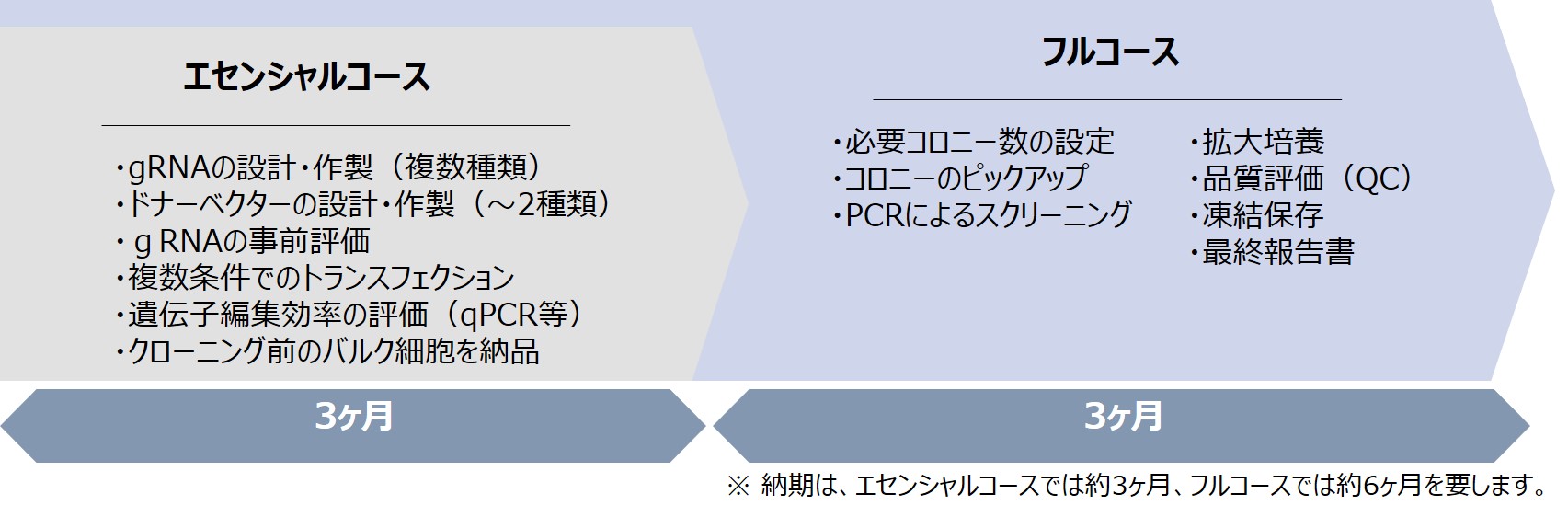
2)サービスメニュー
「エセンシャルコース」は、ゲノム編集の初期のステップ(gRNA/ドナーベクターのデザインや条件最適化等)のサービスとなります。本コースには、周郷式ゲノム編集サービスの技術が集約されており、高い成功確率での遺伝子編集を可能とします。なお、その後のプロセスはお客様で実施していただきます。 「フルコース」では、 「エセンシャルコース」後のクローニングおよび拡大培養等を全て行い、品質評価を経て、目的の遺伝子編集細胞をお届けします。
3)ライセンス取得状況
リプロセルと協業をしているGenAhead Bio社は、研究用として、ERS Genomics Ltd及びBROAD INSTITUTEとライセンス契約を締結しております。
本サービスで作製された細胞は、internal research 以外に共同研究先や研究委託先での使用も可能です。
ゲノム編集サービスを委託いただく場合は、Use and Limited License(GenAhead Bio社サイト)をお読み頂くようお願いいたします。
Use and Limited License には、ERS Genomics Ltd及びBROAD INSTITUTE両社の特許を利用するための条件が記載されており、弊社にゲノム編集を委託いただいた場合は、本規約に同意いただいたものと理解させていただきます。
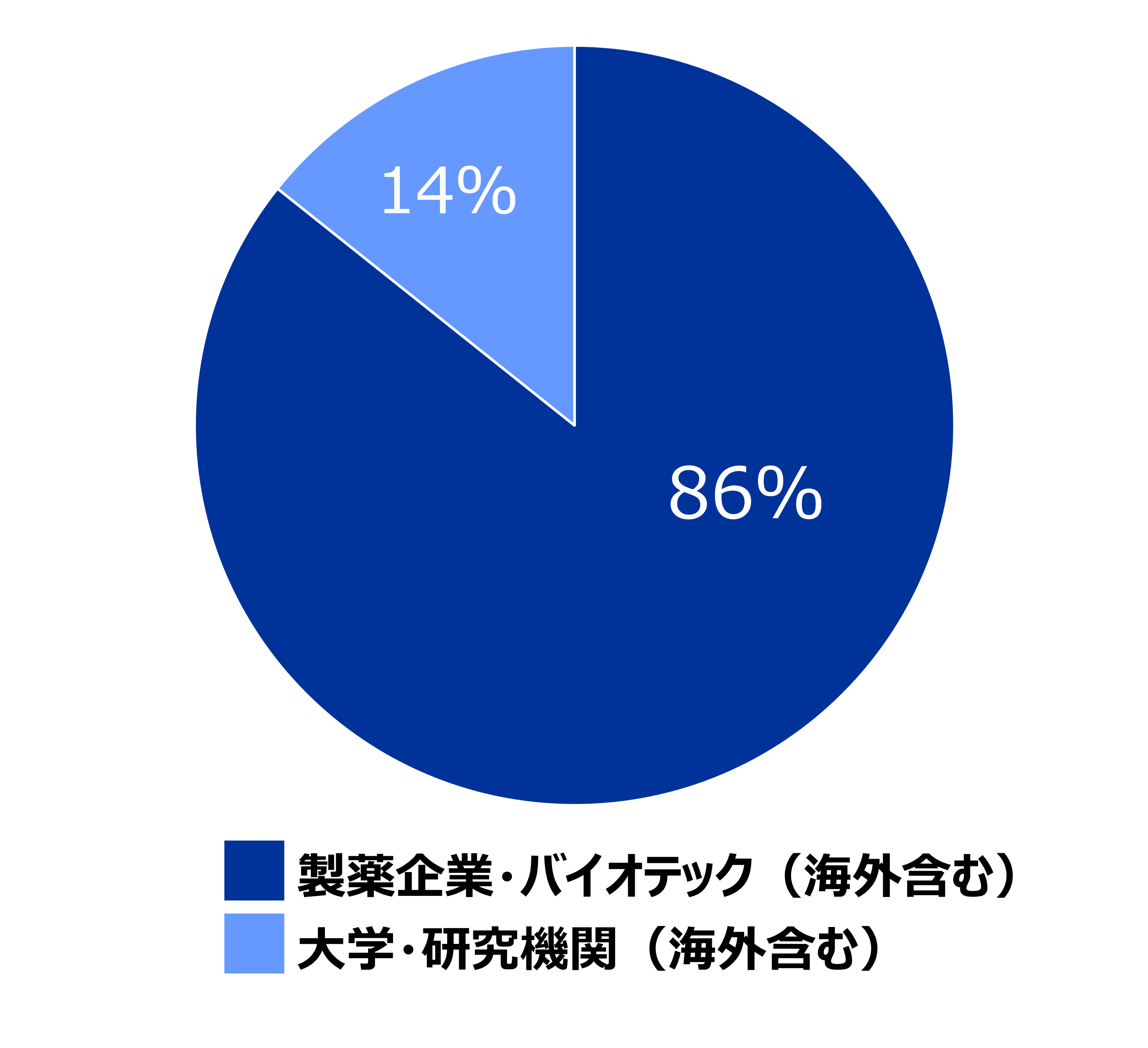
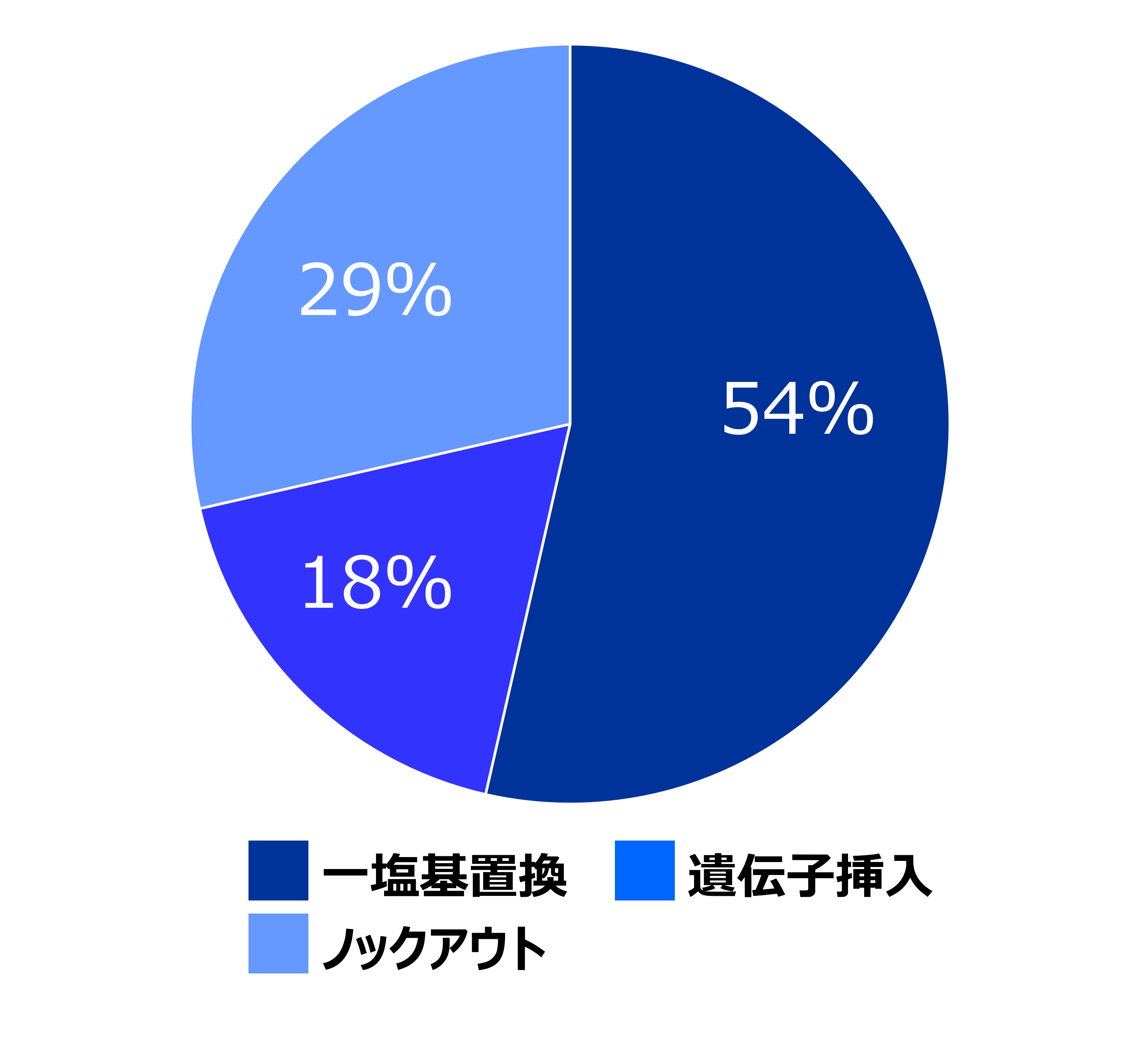
4)ゲノム編集受託実績(2022年6月現在)
受託サービス開始から依頼を受けた細胞は全てがヒトiPS細胞でした。顧客の内訳は、海外を含む製薬会社およびバイオテックからの依頼が86%、海外を含む大学・研究機関からの依頼が14%となっています(左グラフ)。実施内容は、一塩基置換が54%、遺伝子挿入が18%、ノックアウトが29%となっています(右グラフ)。
※同一の顧客から複数の依頼があった場合は複数で計算しています。
顧客 |
実施内容 |
 |
 |
5)ゲノム編集を用いた細胞作製例
実例1.一塩基などの特定の変異をホモおよびヘテロにてノックインした細胞を提供
<<疾患モデルに合わせたホモ変異、ヘテロ変異の細胞を作り分けたい方>>
疾患モデル研究においては、ホモ変異かヘテロ変異かで表現型が異なる場合が有り、それらの要望に合わせて細胞を入手する必要があります。
従来の編集効率だけでは両アレルのノックイン修飾体はまれにしか単離されてきませんでしたが、独自のSNIPER技術により、両鎖とも修飾できるレベルまで遺伝子編集条件を最適化することで、ホモ変異株、ヘテロ変異株を作り分けて容易に取得できます。
目的:56 bp欠損変異モデル(ホモ変異、ヘテロ変異)の作製
細胞:ヒトiPS細胞
ノックインドナー:Δ56 bp ドナー
遺伝子編集後に得られたiPS細胞のクローンを解析した結果、低分子量のみとなるHomo、遅れて溶出されるヘテロ2本鎖も検出されるHeteroでのノックイン細胞ならびにノックアウト細胞と複数種類のiPS細胞クローンが高頻度に取得されてきました。
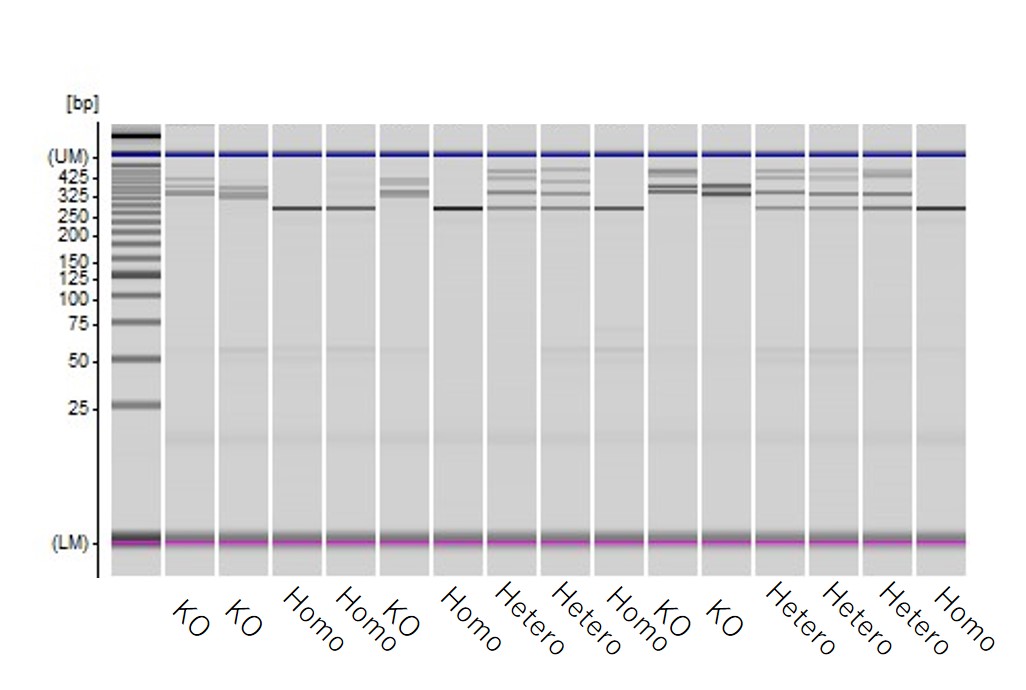
実例2.類似した遺伝子を区別して、要望の遺伝子だけに変異が入った細胞を提供
<<対象の遺伝子をピンポイントで編集したい方>>
遺伝子編集を計画する際に、遺伝子編集の標的配列と相同性の高い配列が存在すると、希望の細胞の取得が困難となります。しかしながら、我々は、Nickaseを効果的に用いることで特異性を高めて対処します。Nickaseでは遺伝子編集効率は低下しますが、パラメータが多いため、念入りに最適化を実施します。加えて、gRNA, ドナーDNAのデザインも綿密に行い、正確に作り分けることが難しかった細胞を手に入れることができます。
目的:HLA-AとHLA-Bを区別して遺伝子編集された細胞作製
細胞:HCT-116
コピーナンバーの定量:トランスフェクションしたバルク培養からゲノムDNAを回収しqPCRで定量
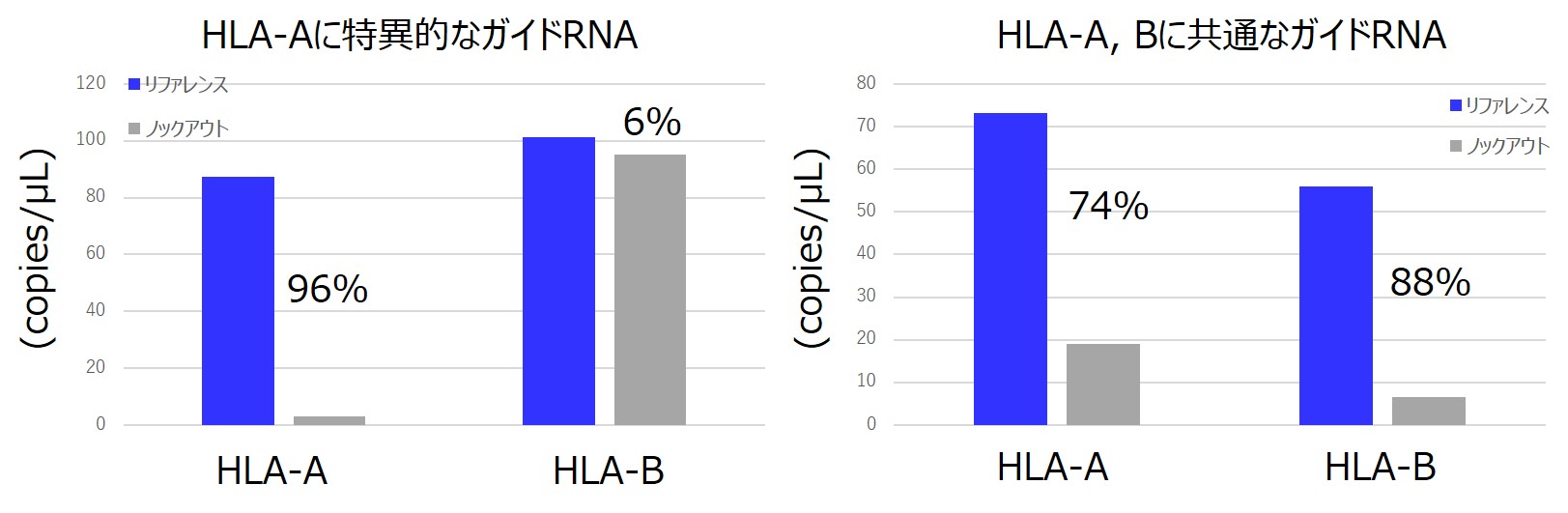
HLA-Aの配列に特異的なgRNAを用いることで、HLA-Bの配列は維持したまま、HLA-Aのみの配列を破壊することができました(左図)。 HLA-AおよびHLA-Bに共通な配列に対するgRNAを用いることで、HLA-A、HLA-Bのどちらの配列も破壊することができました(右図)。
実例3.一度に複数の遺伝子を編集された細胞集団を提供
<<細胞の継代数を増やさずに複数の遺伝子を編集したい方>>
複数の遺伝子を編集するためには、一般的には複数回の遺伝子編集作業が必要となり、iPS細胞においては、細胞の継代数が増える原因となってしまいます。我々は、異なる切断活性を有するgRNAを併用し、それらの編集効率を最適化することで、一度に複数の遺伝子にIndelの入った細胞集団を取得いたします。累積編集率に応じ細胞の単離も行い、それらの細胞の提供も可能です。
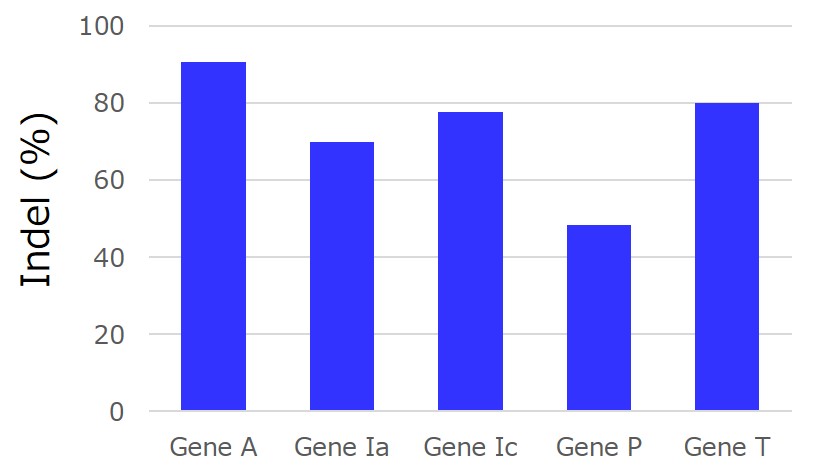
目的:5種類の遺伝子を同時に編集した細胞の作製
細胞:HCT-116
コピーナンバーの定量:トランスフェクションしたバルク培養からゲノムDNAを回収しqPCRで定量
5種類のgRNAを同時にトランスフェクションし、5個の遺伝子に同時にindelを導入できました。iPS細胞で実施することで、継代数を増やすことなく、複数の遺伝子をノックアウトした細胞を単離できる可能性があります。
実例4.Long Donor DNAを用いて高度に遺伝子編集された細胞を提供
<<一般的な手法では困難な難易度の高い遺伝子編集をご要望の方>>
一般的に使用されるssDNAだけでなく、long donor DNAを用いることで、より高い編集効率や広範囲にわたる変異の導入、cisで変異の導入等のご要望にお応えいたします。これにより、従来の遺伝子編集効率では作製が困難であったノックイン細胞を手に入れることができます。

実例5.比較的な大きな機能的遺伝子断片が挿入された細胞の提供
<<挿入サイズによって遺伝子編集をあきらめていた方>>
外来遺伝子や抗生物質耐性遺伝子などの機能的遺伝子断片を挿入する際は、通例2 kbpを超えると挿入率が低下してきます。しかしながら、我々は、大きな遺伝子断片の挿入率を独自技術であるSNIPERで評価することで、編集条件の最適化を実施いたします。本技術による編集効率の最適化の結果、より大きなサイズ(5-7 kbp)の遺伝子断片が挿入された細胞の取得実績があります。
実例6.iPS細胞からの分化過程を容易に追跡できる細胞を提供
<< iPS細胞を用いた分化誘導試験を計画されている方>>
iPS細胞を用いた研究では、目的の細胞への分化誘導条件の検討や分化を促進する化合物のスクリーニングが頻繁に実施されています(1)。このような試験には、特定の細胞に分化するとGFPを発現する細胞が利用されてきました。我々も、分化細胞に特異的な分化マーカーのC末端に蛍光タンパク質を挿入したiPS細胞を作製した実績があり、分化過程の追跡に最適な細胞の提供が可能です。
(1)Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Den Hartogh SC et al. Stem Cells. (2016)
6-1)疾患モデルiPS細胞への応用方法
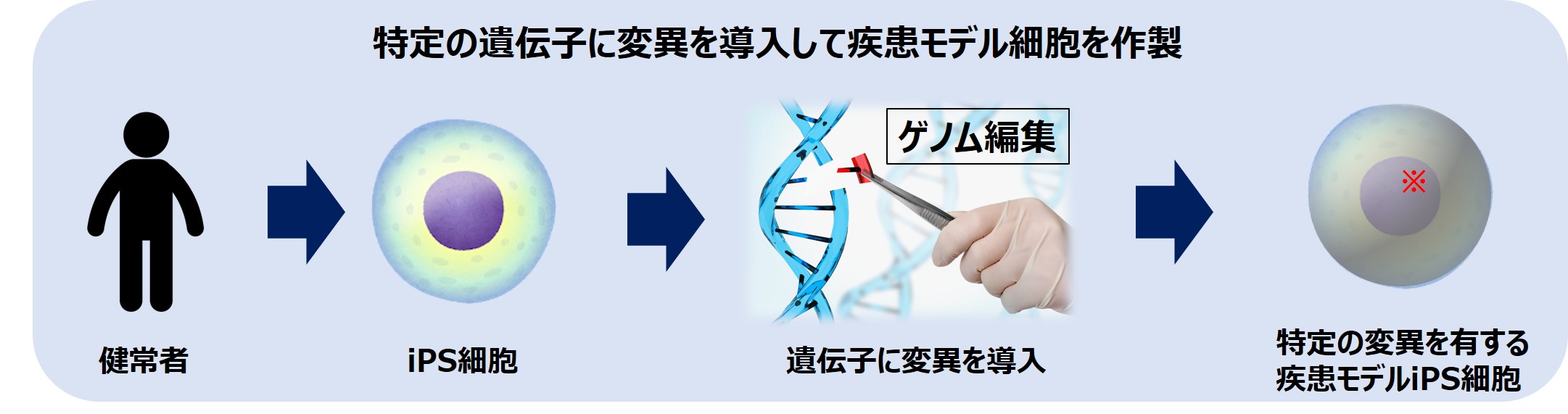
ゲノム編集技術を使用することで、健常人由来のiPS細胞の特定の遺伝子に特定の変異(一塩基置換等)を導入することができます。
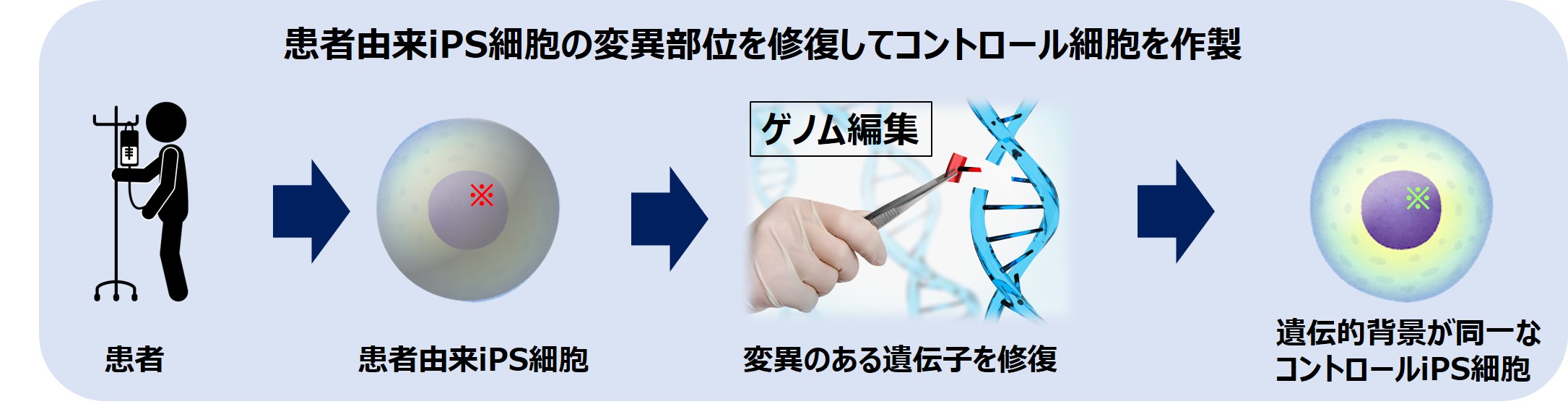
疾患患者由来のiPS細胞の遺伝子変異をゲノム編集技術で修復することで、患者由来iPS細胞と遺伝的背景が同一なiPS細胞を手に入れることができます。
6-2)疾患モデルiPS細胞への応用方法(アルツハイマー病モデル)

アルツハイマー病の原因遺伝子の1つであるPresenilin(PS1)に変異(P117L)を入れたiPS細胞を作製し、神経細胞へと分化誘導して、モデル細胞を作製しました。
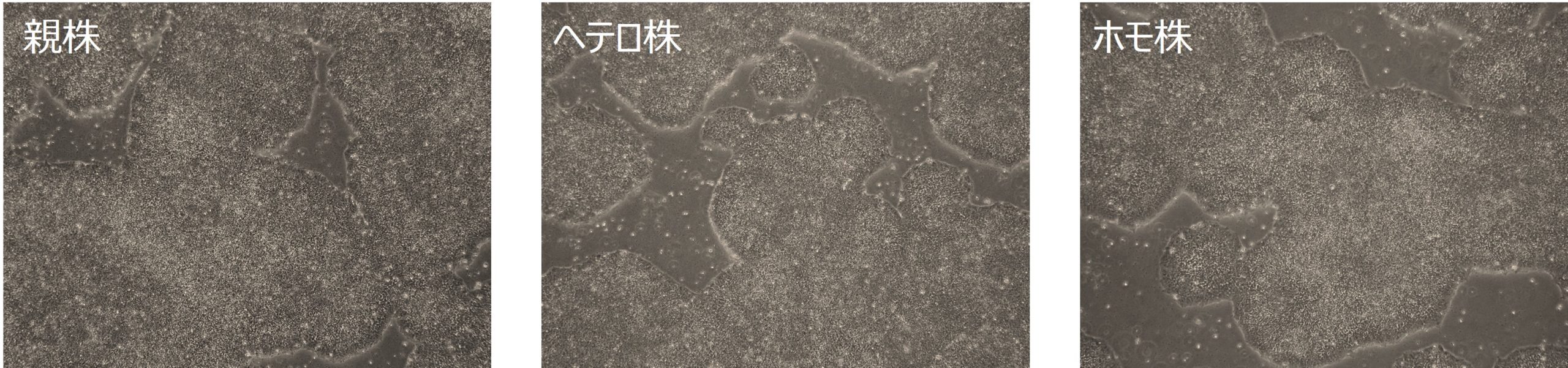
片方のアレルに変異(P117L)が入ったヘテロ株と両方のアレルに変異(P117L)が入ったホモ株のどちらも作製しました。親株と同様に未分化状態を維持しています。
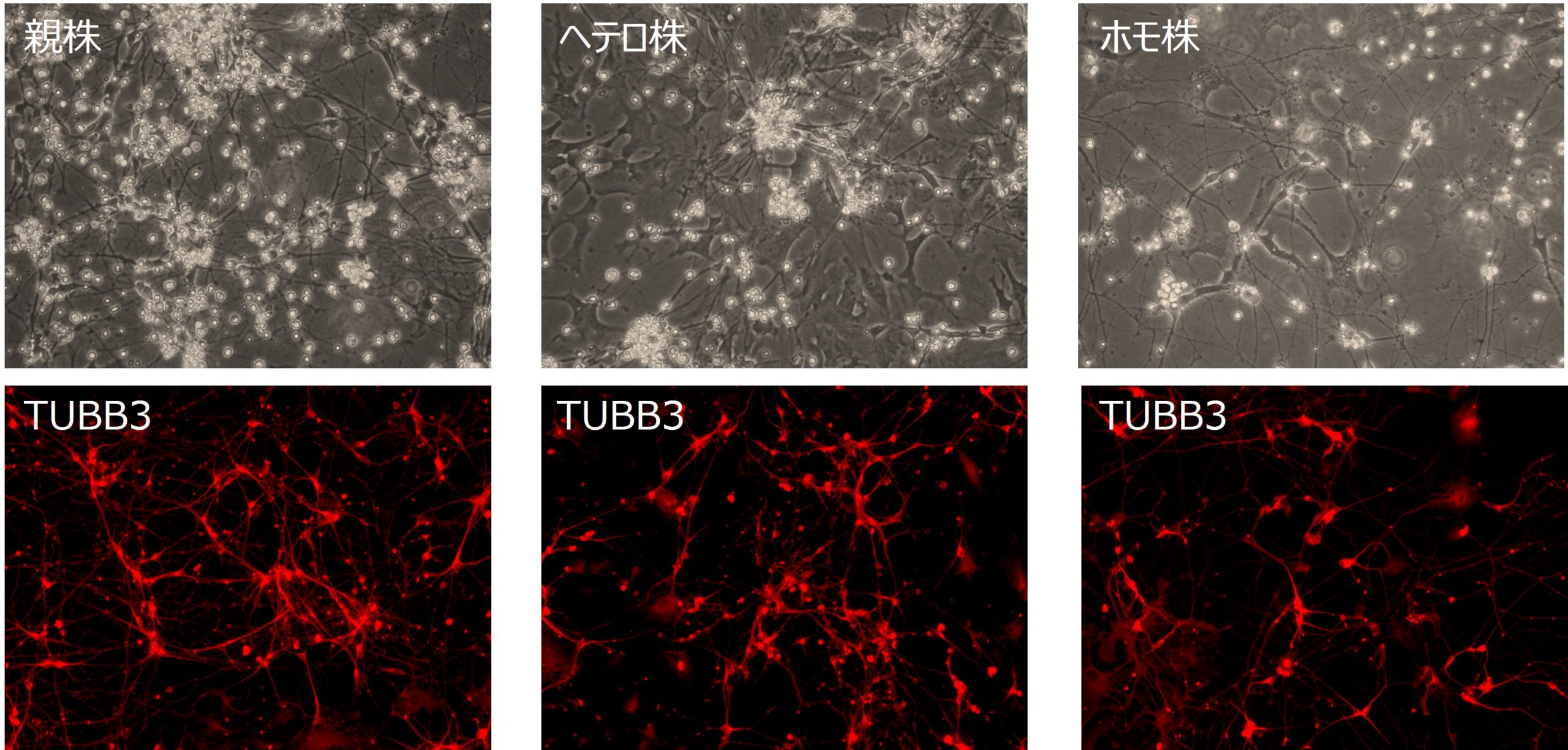
ヘテロ株とホモ株を神経細胞に分化誘導しました。親株と同様に神経突起を有した神経細胞へと分化誘導されました。(上図:位相差画像、下図:Neuron marker (赤色 TUBB3))
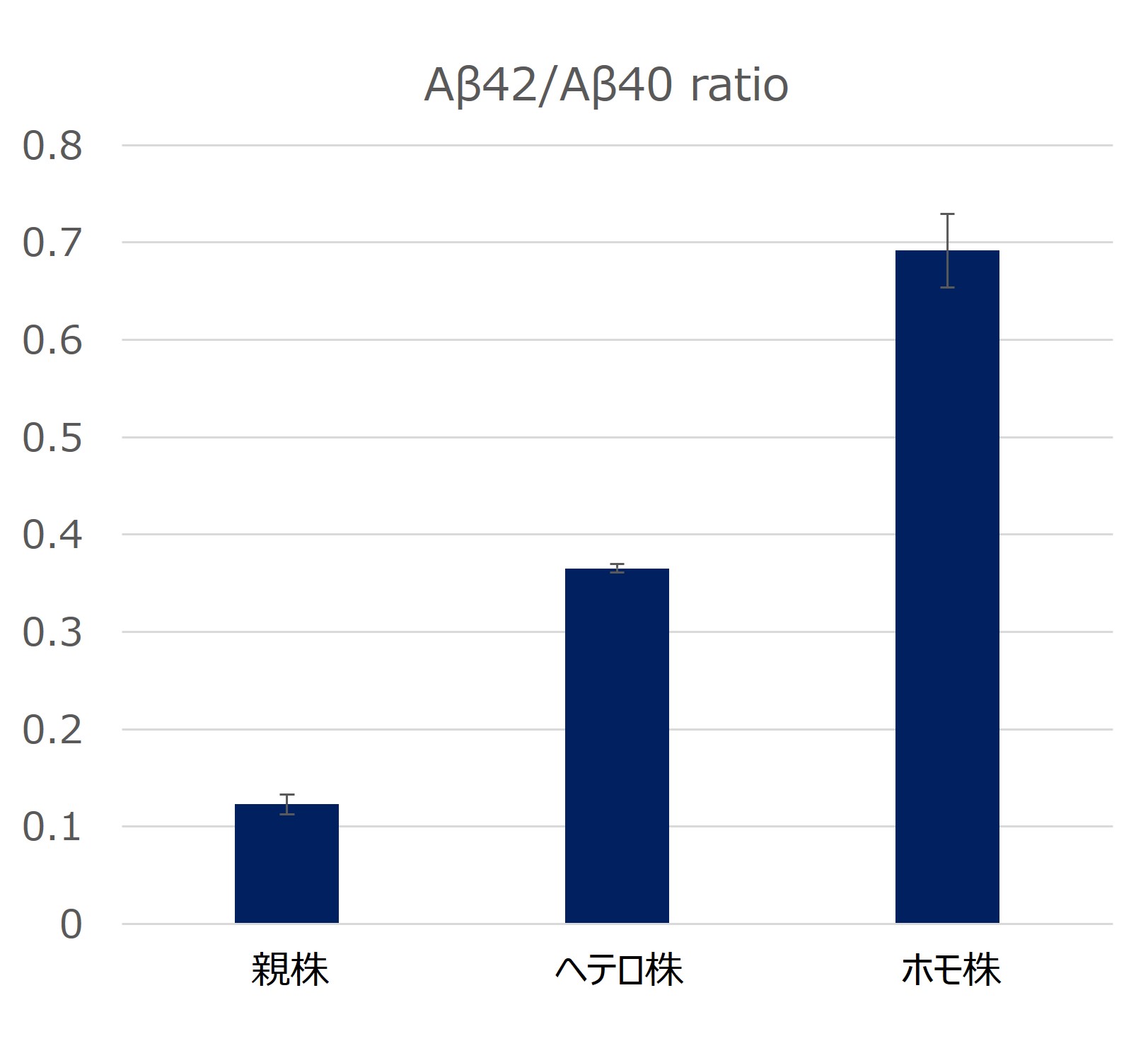
神経細胞へと分化誘導したアルツハイマー病モデル細胞(親株、ヘテロ株、ホモ株)の培養外液のAβ濃度を測定しました。親株と比較して、ヘテロ株、ホモ株と段階的にAβ42の産生割合が増加することが確認できています。n=3
7)iPS細胞を用いた疾患モデル研究におけるCRISPR/Cas9使用の報告例
対象疾患 |
対象遺伝子 |
文献 |
|---|---|---|
| デュシェンヌ型 筋ジストロフィー |
Dystrophin | Methods Mol Biol. 2018;1828:191-217. doi: 10.1007/978-1-4939-8651-4_12 |
| DMPK | Stem Cell Reports. 2015 Jan 13;4(1):143-54. doi: 10.1016/j.stemcr.2014.10.013 | |
| 1型筋強直性 ジストロフィー |
Dystrophin | Nucleic Acids Res. 2018 Sep 19;46(16):8275-8298. doi: 10.1093/nar/gky548 |
| 小児急性 B リンパ芽球性白血病 | ETV6-RUNX1 | Dev Cell. 2018 Feb 5;44(3):362-377.e7. doi: 10.1016/j.devcel.2017.12.005 |
| ブラウ症候群 | NOD2 | J Allergy Clin Immunol. 2018 Jan;141(1):339-349.e11. doi: 10.1016/j.jaci.2017.04.013 |
| QT延長症候群 | CALM2 | Hum Mol Genet. 2017 May 1;26(9):1670-1677. doi: 10.1093/hmg/ddx073 |
| 自閉症 スペクトラム症 |
CHD8 | Mol Autism. 2017 Mar 20;8:11. doi: 10.1186/s13229-017-0124-1 |
| β-サラセミア | HBB | J Biol Chem. 2016 Aug 5;291(32):16576-85. doi: 10.1074/jbc.M116.719237 |
| 慢性肉芽腫 | CYBB | Exp Hematol. 2015 Oct;43(10):838-848.e3. doi: 10.1016/j.exphem.2015.06.002 |
| ICF症候群 | DNMT3B | Int J Mol Sci. 2013 Sep 30;14(10):19774-81. doi: 10.3390/ijms141019774 |
8)ゲノム編集サービス一覧
品番 |
製品名 |
応用例 |
希望小売価格 |
|---|---|---|---|
| RCGB001 | Gene editing service SNP (一塩基置換細胞作製) |
・疾患関連一塩基の置換 |
お問い合わせ下さい |
| RCGB002 | Gene editing service KI (ノックイン細胞作製) |
・分化マーカーとしての蛍光蛋白質の導入 ・ご要望の遺伝子を導入 |
|
| RCGB003 | Gene editing service KO (ノックアウト細胞作製) |
・非相同性末端結合(NHEJ)による破壊 ・ストップコドンの挿入 ・エキソン等の除去 |
※上記サービスメニューは参考となります。お客様のご要望に応じて、最適な編集設計と試験スキームを都度ご提案いたします。
※当社はiPSアカデミアジャパン株式会社より、商用ライセンスを取得しております。
9)GenAhead Bio社代表

薬学博士
周郷 司(すごう つかさ)
【略歴】 東京大学 薬学部卒 東京大学 医科学研究所 武田薬品工業株式会社にて、GPCR研究、核酸医薬研究、ゲノム編集研究に従事 (25年)。その間、Alnylam Pharmaceuticals 客員研究員を経て、株式会社GenAhead Bio CEO <研究実績> オーファンGPCRのリガンドとして、新規ホルモンの発見 (urotensin II, urotensin II related peptide, lysoPS) 1 免疫細胞、骨格筋、心筋への核酸のデリバリー方法の開発 2 効率的なゲノム編集のためにSNIPER法を開発 3, 4
10)参考
- Another ligand fishing for G protein-coupled receptor 14 –Discovery of urotensin II-related peptide in the rat brain. Sugo T., and Mori M. Peptides 29, 809-12. (2008) etc.
- Development of antibody-siRNA conjugate targeted to cardiac and skeletal muscles. Sugo T. et al.. J. Control. Release 237, 1-13. (2016)
- CRISPRの登場以降、前職での多数の実績を元に、スピンアウトベンチャーとして、広く全国の大手製薬会社、大学にサービスを展開中。
- 特に長鎖のノックイン(KI)ドナーでは、残留ドナーがゲノム編集の検出を妨害したり、ゲノムの意図した位置以外に挿入されることは避けられないため、ゲノム編集操作後、SNIPER法により正確な挿入/ランダム挿入の程度をモニターし、早期に、正しいKIが多く、非特異的KIが少ない条件で改変処理された細胞群からのクローン単離に移ります。ゲノム編集作業は、長期にわたる複雑な作業なため、この様なごく早期にGo/No Go判定を行うことが、プロジェクトの運営上(費用面、時間管理面)有用です。
