
目的細胞の取得率実績

CRISPR/Cas9
ゲノム編集受託
▶iPS細胞・株化細胞で150試験以上の実績
▶SNPなど高難易度の編集実績多数
ゲノム編集とは
ゲノム編集とは、生物が持つ全遺伝情報(ゲノム)を構成するDNAの塩基配列を、特定の場所で正確に書き換える技術です。従来の遺伝子組換え技術よりも高い精度で、狙った遺伝子だけを効率的に改変できる点が大きな特徴です。CRISPR-Cas9などの「分子のはさみ」を用いてDNAを切断・修復し、遺伝情報を改変します。現在では、様々な研究分野で利用されていて、生命科学の基礎研究においては、特定の遺伝子の機能を詳細に調べるために重要なツールとなっています。さらに遺伝病の治療やがん研究といった医療分野での使用も期待されています。
疾患モデルiPS細胞への応用方法
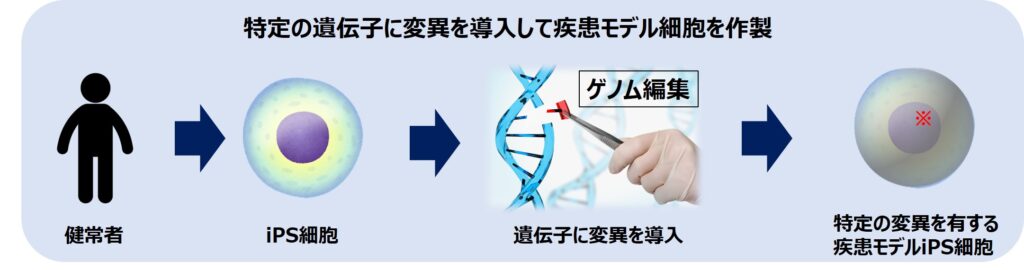
ゲノム編集技術を使用することで、健常人由来のiPS細胞の特定の遺伝子に特定の変異(一塩基置換等)を導入することができます。
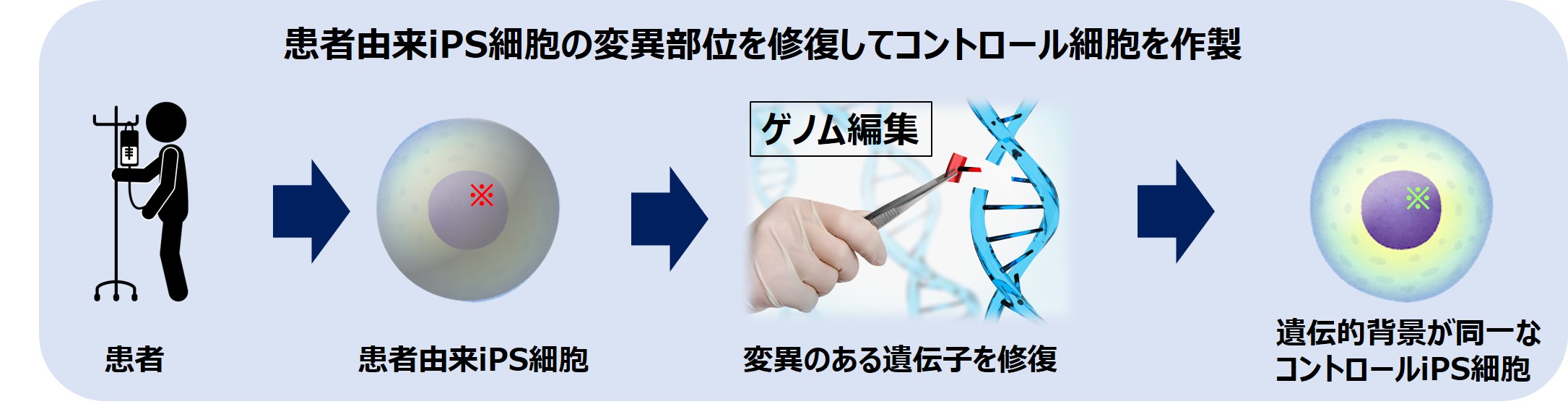
疾患患者由来のiPS細胞の遺伝子変異をゲノム編集技術で修復することで、患者由来iPS細胞と遺伝的背景が同一なiPS細胞を手に入れることができます。
疾患モデルiPS細胞への応用方法(アルツハイマー病モデル)

アルツハイマー病の原因遺伝子の1つであるPresenilin(PS1)に変異(P117L)を入れたiPS細胞を作製し、神経細胞へと分化誘導して、モデル細胞を作製しました。
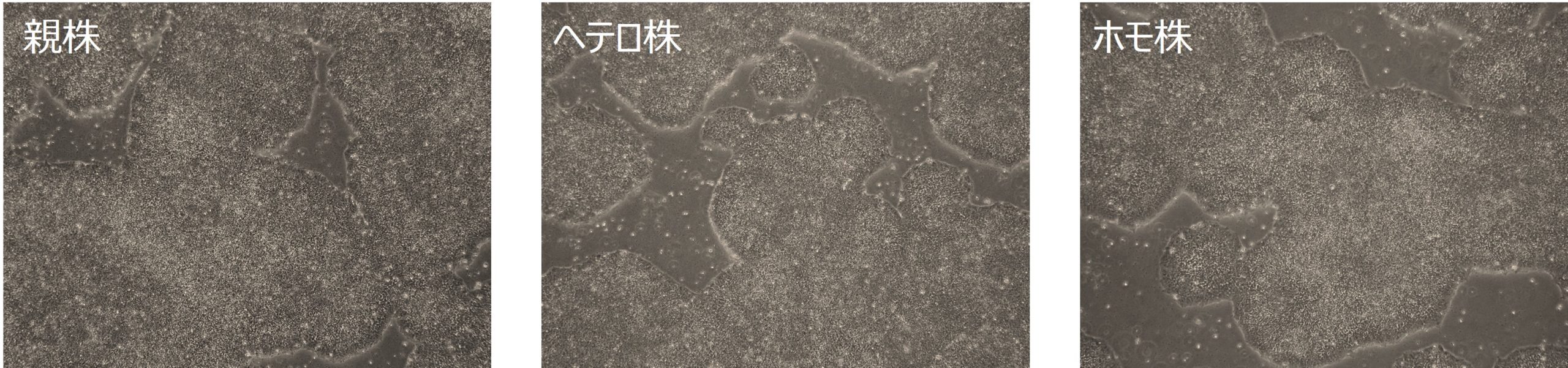
片方のアレルに変異(P117L)が入ったヘテロ株と両方のアレルに変異(P117L)が入ったホモ株のどちらも作製しました。親株と同様に未分化状態を維持しています。
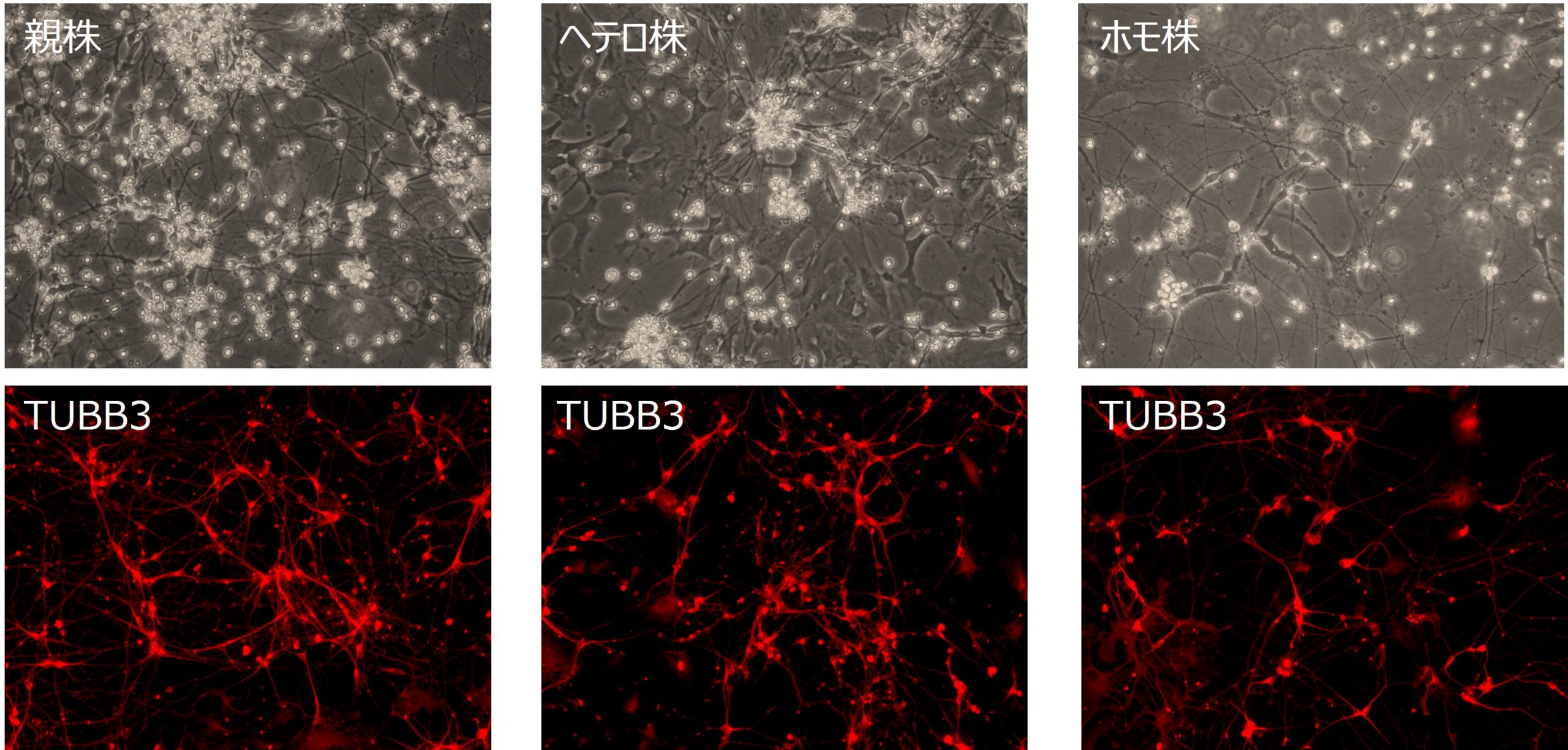
ヘテロ株とホモ株を神経細胞に分化誘導しました。親株と同様に神経突起を有した神経細胞へと分化誘導されました。(上図:位相差画像、下図:Neuron marker (赤色 TUBB3))
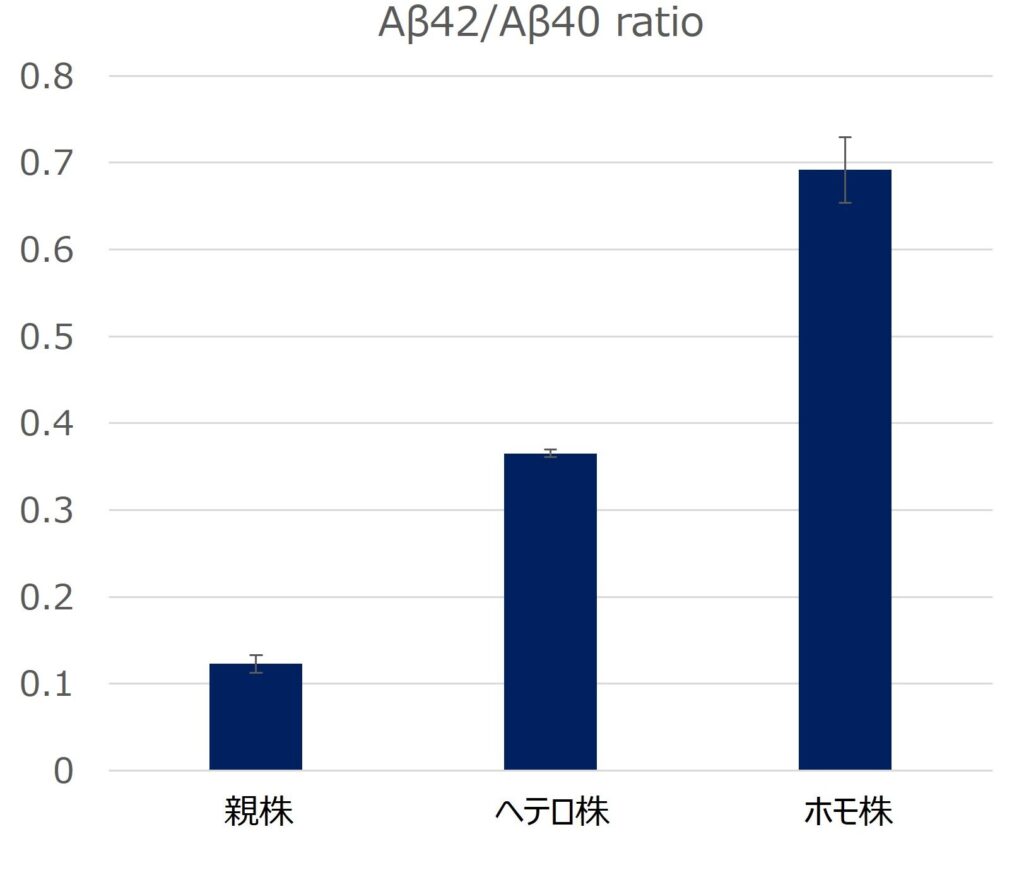
神経細胞へと分化誘導したアルツハイマー病モデル細胞(親株、ヘテロ株、ホモ株)の培養外液のAβ濃度を測定しました。親株と比較して、ヘテロ株、ホモ株と段階的にAβ42の産生割合が増加することが確認できています。n=3
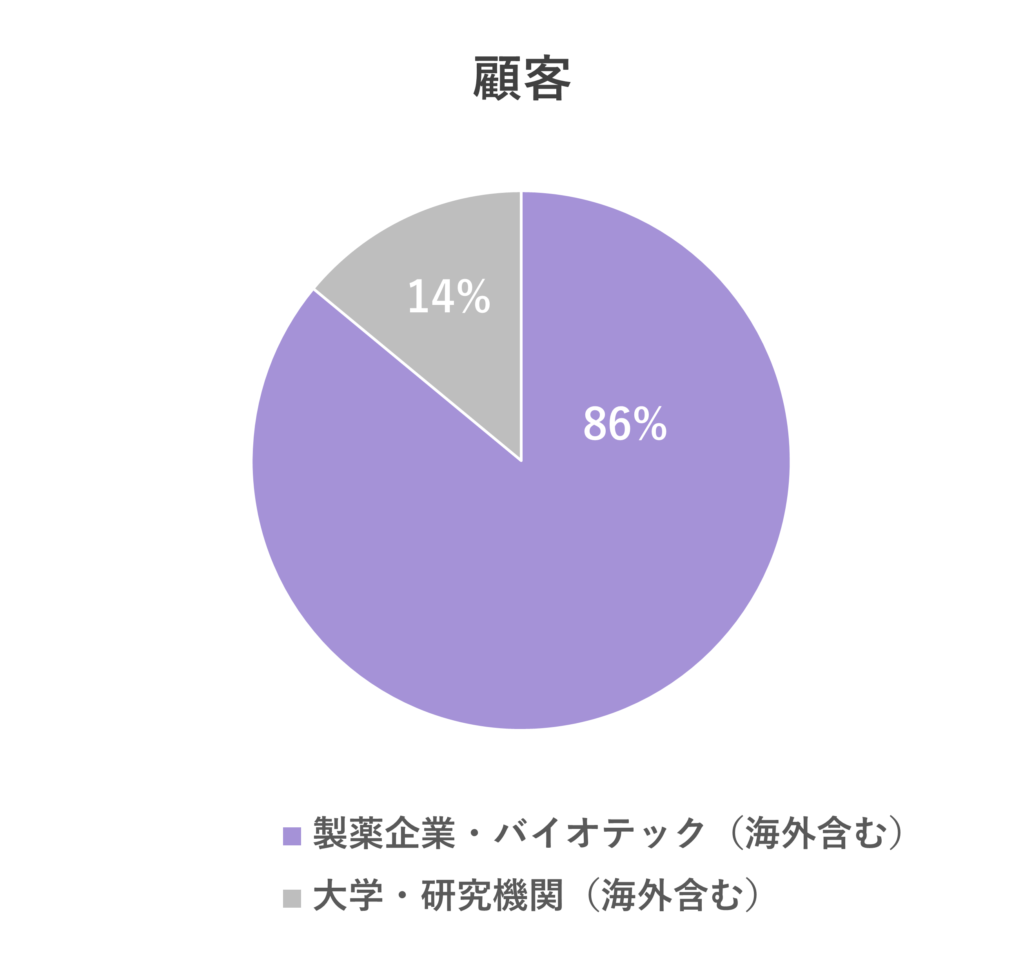
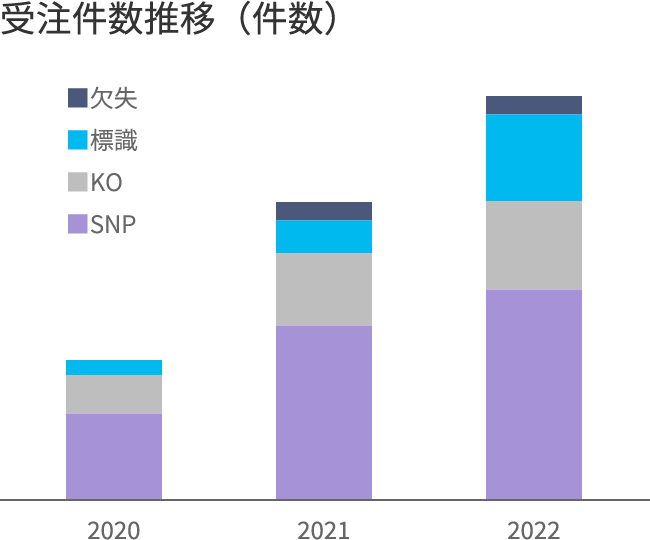
ご注文いただくお客様の内訳状況
※同一のお客様から複数の依頼があった場合は複数で計算しています。
複数回ゲノム編集を実施したが、目的細胞を取得出来なかった…


CIRSPR/Cas9に独自技術『SNIPER』を掛け合わせることにより、過去実績で目的細胞の取得率100%を達成しています。
高難易度の編集もお受けします。
目的細胞の取得率100%の秘訣は独自技術の『SNIPER』です。
『SNIPER』とは、ゲノム編集作業の初期段階に最終的な編集効率を定量解析する手法です。
解析結果を踏まえ編集効率の高い条件を選定することができるため、最終的な目的細胞の取得率が飛躍的に高まります。
武田薬品工業からスピンアウトしたGenAhead Bio社との協業により画期的なゲノム編集サービスを提供しております。同社社長の周郷氏により開発された新規技術(CRISPR-SNIPER)を用い、一塩基置換やホモ/ヘテロ変異の作り分けなど難易度の高い遺伝子編集を高い成功確率で提供いたします。
●ゲノム編集の受託件数は年々増加しており、iPS細胞をはじめ、細胞株の実績も豊富です。
ゲノム編集の仕方が分からない…


150試験以上の実績を踏まえ、ゲノム編集デザインから全てご提案します。
これまでの経験を活かし最適と考えられるゲノム編集デザイン(gRNA/ドナーベクターの設計)のご提案が可能です。
自施設で成功しなかったプロジェクトや、アイデア段階でもご要望(ターゲットの遺伝子や編集内容)を伝えていただくだけで、最適デザイン案をご案内いたしますのでお気軽にご相談ください。
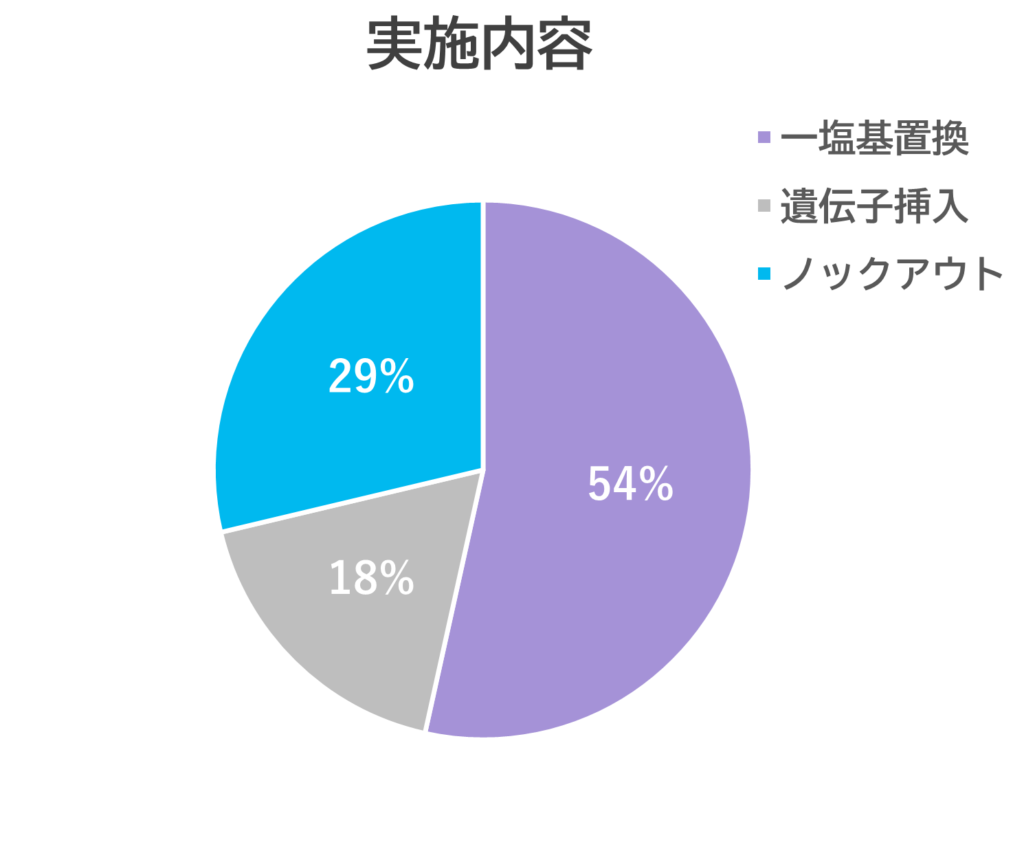
これまでの実施例
◎健康者由来のiPS細胞+SNP
◎疾患者由来のiPS細胞+KO
◎株化癌細胞+蛍光レポーター
◎浮遊系細胞+KI など
高難易度の編集依頼なので
金銭的なリスクを軽減したい…


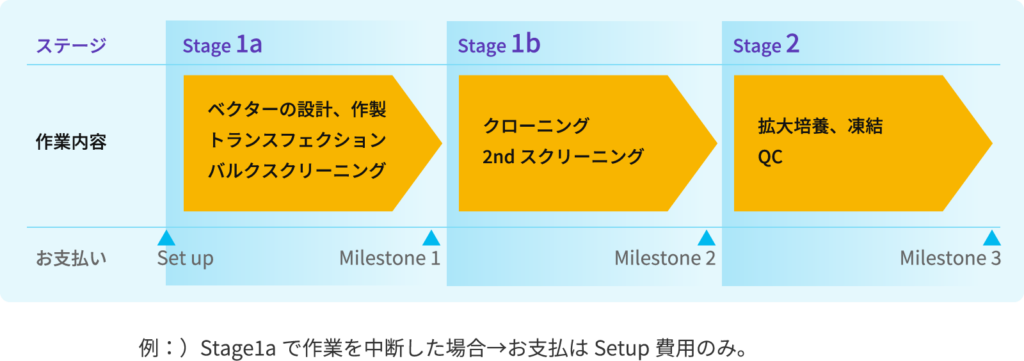
作業は3つのステージに分かれます。
万が一作業が中断した場合は、その先の費用はいただきません。
作業は3つのステージから成り、お支払いは4回に分かれます。各ステージの作業結果を踏
まえ、次のステージに進むかをご判断いただけます。
ライセンス詳細はこちらからご確認ください。
具体例

実例1.一塩基などの特定の変異をホモおよびヘテロにてノックインした細胞を提供
<<疾患モデルに合わせたホモ変異、ヘテロ変異の細胞を作り分けたい方>>
疾患モデル研究においては、ホモ変異かヘテロ変異かで表現型が異なる場合が有り、それらの要望に合わせて細胞を入手する必要があります。
従来の編集効率だけでは両アレルのノックイン修飾体はまれにしか単離されてきませんでしたが、独自のSNIPER技術により、両鎖とも修飾できるレベルまで遺伝子編集条件を最適化することで、ホモ変異株、ヘテロ変異株を作り分けて容易に取得できます。
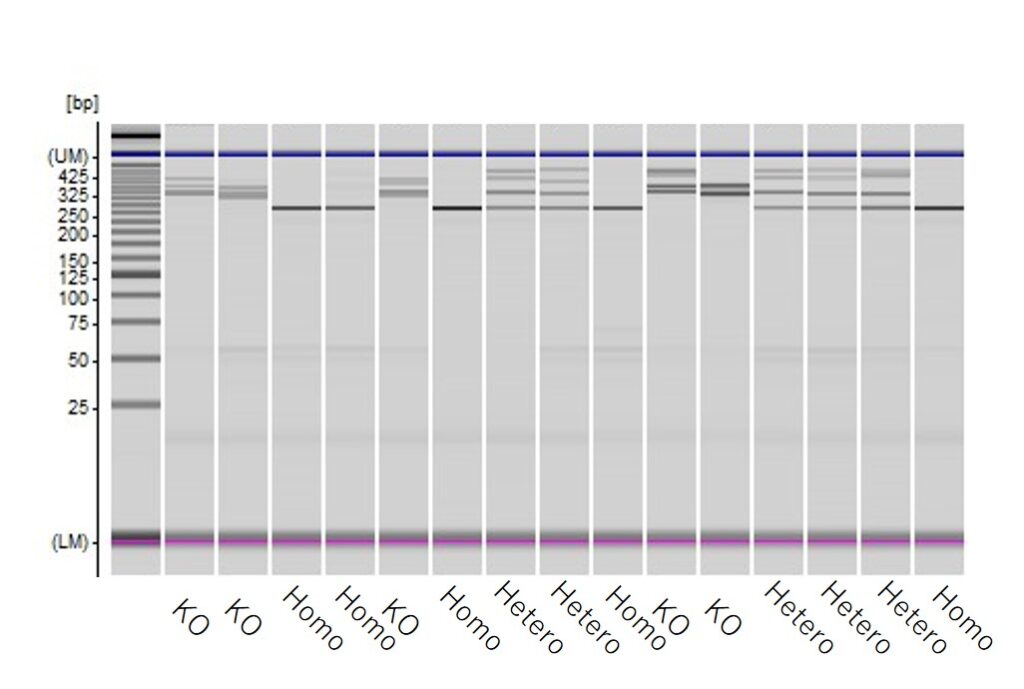
目的:56 bp欠損変異モデル(ホモ変異、ヘテロ変異)の作製
細胞:ヒトiPS細胞
ノックインドナー:Δ56 bp ドナー
遺伝子編集後に得られたiPS細胞のクローンを解析した結果、低分子量のみとなるHomo、遅れて溶出されるヘテロ2本鎖も検出されるHeteroでのノックイン細胞ならびにノックアウト細胞と複数種類のiPS細胞クローンが高頻度に取得されてきました。

実例2.一度に複数の遺伝子を編集された細胞集団を提供
<<細胞の継代数を増やさずに複数の遺伝子を編集したい方>>
複数の遺伝子を編集するためには、一般的には複数回の遺伝子編集作業が必要となり、iPS細胞においては、細胞の継代数が増える原因となってしまいます。我々は、異なる切断活性を有するgRNAを併用し、それらの編集効率を最適化することで、一度に複数の遺伝子にIndelの入った細胞集団を取得いたします。累積編集率に応じ細胞の単離も行い、それらの細胞の提供も可能です。
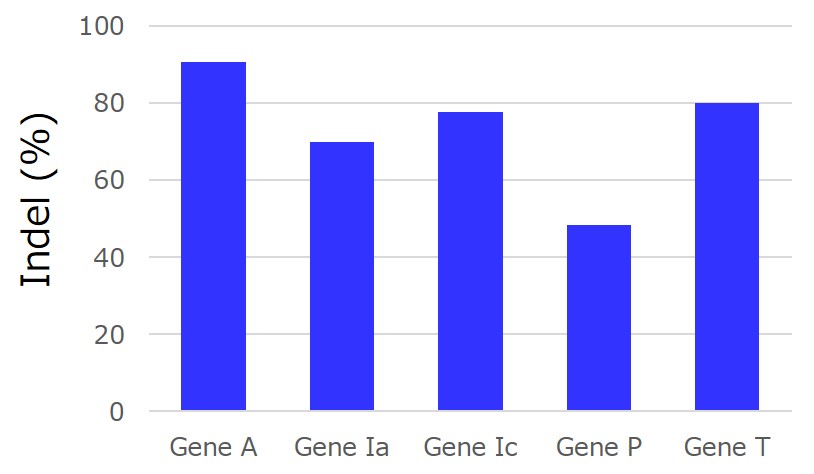
目的:5種類の遺伝子を同時に編集した細胞の作製
細胞:HCT-116
コピーナンバーの定量:トランスフェクションしたバルク培養からゲノムDNAを回収しqPCRで定量
5種類のgRNAを同時にトランスフェクションし、5個の遺伝子に同時にindelを導入できました。iPS細胞で実施することで、継代数を増やすことなく、複数の遺伝子をノックアウトした細胞を単離できる可能性があります。

実例3.iPS細胞からの分化過程を容易に追跡できる細胞を提供
<< iPS細胞を用いた分化誘導試験を計画されている方>>
iPS細胞を用いた研究では、目的の細胞への分化誘導条件の検討や分化を促進する化合物のスクリーニングが頻繁に実施されています(1)。このような試験には、特定の細胞に分化するとGFPを発現する細胞が利用されてきました。我々も、分化細胞に特異的な分化マーカーのC末端に蛍光タンパク質を挿入したiPS細胞を作製した実績があり、分化過程の追跡に最適な細胞の提供が可能です。
(1)Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Den Hartogh SC et al. Stem Cells. (2016)
[目的細胞の取得率100%] CRISPR/Cas9 ゲノム編集サービス
ライセンス
●研究用として、ERS Genomics Ltd及び BROAD INSTITUTEとライセンス契約を締結した株式会社GenAhead Bioにゲノム編集を委託しています。
●本サービスで提供した細胞は社内研究以外にも共同研究先や研究委託先での使用も可能です。
導入事例(文献)
- Szewczyk MM, Ishikawa Y, Organ S, Sakai N, Li F, Halabelian L, Ackloo S, Couzens AL, Eram M, Dilworth D, Fukushi H, Harding R, Dela Seña CC, Sugo T, Hayashi K, McLeod D, Zepeda C, Aman A, Sánchez-Osuna M, Bonneil E, Takagi S, Al-Awar R, Tyers M, Richard S, Takizawa M, Gingras AC, Arrowsmith CH, Vedadi M, Brown PJ, Nara H, Barsyte-Lovejoy D. Pharmacological inhibition of PRMT7 links arginine monomethylation to the cellular stress response. Nat Commun. 2020 May 14;11(1):2396. doi: 10.1038/s41467-020-16271-z. Erratum in: Nat Commun. 2020 May 26;11(1):2683. PMID: 32409666; PMCID: PMC7224190.
- Matsuo T, Adachi-Tominari K, Sano O, Kamei T, Nogami M, Ogi K, Okano H, Yano M. Involvement of ferroptosis in human motor neuron cell death. Biochem Biophys Res Commun. 2021 Aug 20;566:24-29. doi: 10.1016/j.bbrc.2021.05.095. Epub 2021 Jun 7. PMID: 34111668.
- Miki K, Deguchi K, Nakanishi-Koakutsu M, Lucena-Cacace A, Kondo S, Fujiwara Y, Hatani T, Sasaki M, Naka Y, Okubo C, Narita M, Takei I, Napier SC, Sugo T, Imaichi S, Monjo T, Ando T, Tamura N, Imahashi K, Nishimoto T, Yoshida Y. ERRγ enhances cardiac maturation with T-tubule formation in human iPSC-derived cardiomyocytes. Nat Commun. 2021 Jun 21;12(1):3596. doi: 10.1038/s41467-021-23816-3. PMID: 34155205; PMCID: PMC8217550.
- Fujiwara Y, Miki K, Deguchi K, Naka Y, Sasaki M, Sakoda A, Narita M, Imaichi S, Sugo T, Funakoshi S, Nishimoto T, Imahashi K, Yoshida Y. ERRγ agonist under mechanical stretching manifests hypertrophic cardiomyopathy phenotypes of engineered cardiac tissue through maturation. Stem Cell Reports. 2023 Sep 21:S2213-6711(23)00362-4. doi: 10.1016/j.stemcr.2023.09.003. Epub ahead of print. PMID: 37802074.
その他のサービス
iPS細胞由来の疾患モデル細胞が欲しい方は、こちらのサービスも併せてご検討ください。
[目的細胞の取得率100%] CRISPR/Cas9 ゲノム編集サービス


