iPS細胞分化誘導受託サービス
1)神経細胞への分化誘導(神経分化)技術
◆- iPS細胞からの分化誘導技術 –
iPS細胞由来の神経細胞は、再生医療のソースとなるだけでなく、当初より疾患機構の解明や新薬開発の分野での利用が考えられていました。特に神経疾患においては、いくつかの疾患で効果的な治療方法が構築されておらず、アンメットメディカルニーズが高い領域であり、積極的に研究が進められている分野です。
我々はヒトiPS細胞由来の神経前駆細胞(ReproNeuroシリーズ)を2010年より提供しており、近年は複数神経細胞種を含んだReproNeuroを始め、ドーパミン作動性神経細胞、感覚神経細胞、運動神経細胞、アストロサイト等への分化誘導技術を開発してきました。これらの技術を活かして御要望に合わせた神経細胞への受託製造を承ります。
論文で報告された方法やお客様保有の方法での分化誘導受託だけでなく、お客様のニーズに合わせた最良の方法を提案します。使用するiPS細胞株を当社で提供することも可能であり、疾患モデル細胞として、ゲノム編集サービスや患者の探索も実施しています。
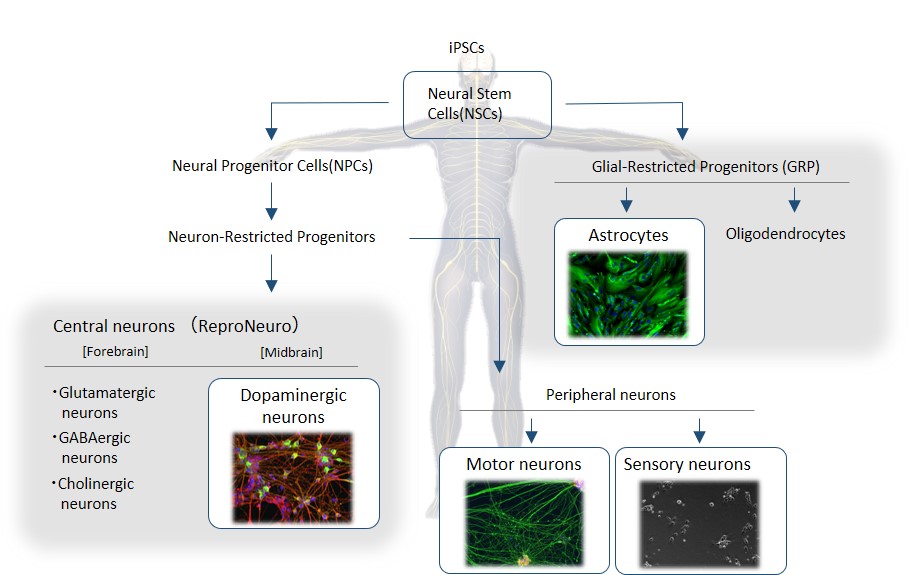

◆中枢神経系神経細胞 (ReproNeuro)
ReproNeuroはグルタミン酸作動性、GABA作動性、ドーパミン作動性、コリン作動性の各神経細胞を含んだミックスポピュレーションです。シナプス関連蛋白質の発現も良好であり、生体に近い反応を表すことが期待できます。凍結された細胞を解凍して播種するだけで簡単にヒト神経細胞をが入手できます。
-神経細胞マーカー-
各種神経細胞マーカーの発現を免疫染色で確認しています。
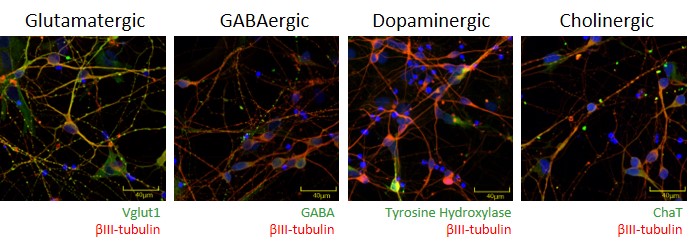
-シナプスの形成(ドレブリンの発現)-
ドレブリンはシナプス後端に存在する蛋白質でシナプス可塑性にも関与しており、スパインの形成およびシナプスの形成のマーカーとしても使用されています。
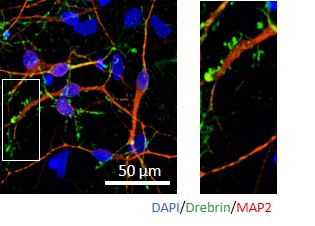
ReproNeuroを2週間以上培養し、ドレブリンの発現を免疫染色で評価しました。神経突起上に、ドレブリンが集積したスパイン様の構造が形成されています。

◆感覚神経細胞 StemRNA Sensory neuron
感覚神経は末梢神経に属しており、皮膚や目などが受けた刺激を脳や脊髄といった中枢神経に伝達する役割を担っています。
本細胞は株式会社ファンケルと共同開発しました(IRはこちら)。細胞体が大きく、感覚神経細胞の特徴を示しています。(下図)
遺伝子発現や薬剤への応答性のデータはこちらをご覧ください。
※日本動物実験代替法学会第34回大会(会期:2021年11月11日~13日)にて、ポスター発表いたしました。(PDFはこちら)
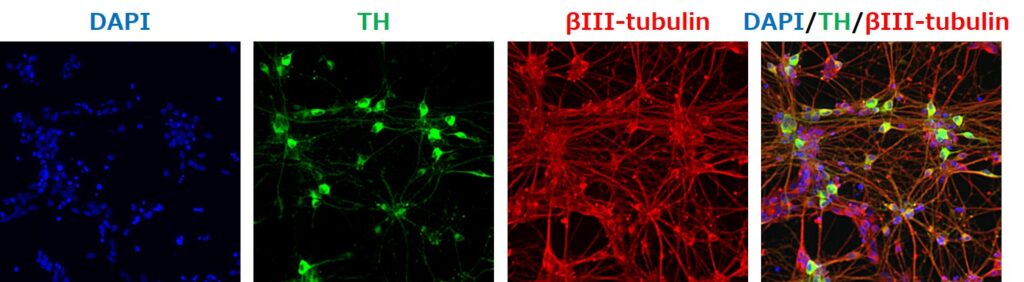
◆ドーパミン作動性神経細胞(Dopaminergic neuron)
パーキンソン病患者において、ドーパミン作動性神経細胞の変性および脱落が知られています。さらに、ドーパミン神経系は、精神疾患との関連も示唆されており、向精神薬の標的としても注目されています。

◆運動神経細胞(Motor neuron)
iPS細胞由来運動神経細胞はALS(筋委縮性側索硬化症)やSMA(脊髄性筋萎縮症)研究の一部として進められてきました。iPS細胞を利用した疾患機構の解明や治療薬開発が強く期待されています。
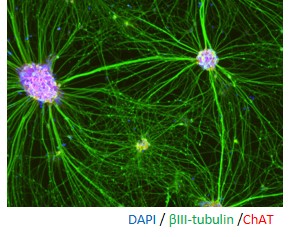
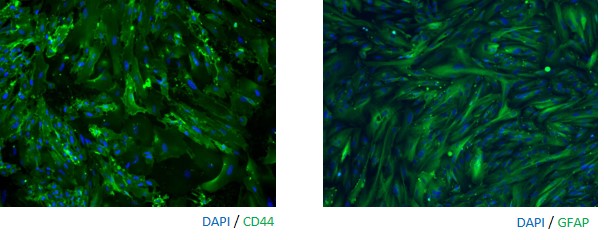
◆アストロサイト(Astrocyte)
アストロサイトは、神経細胞と密接な関係性を保ち、神経ネットワークを維持しています。そのため、iPS細胞の分野においてもアストロサイトとの共培養系を用いた試験が実施されています。近年では、アストロサイトと疾患との関連も報告されており、疾患研究の分野での利用も広まっています。
2)神経細胞成熟化培地(Neuro MQ Medium)
◆Neuro MQ Medium
Neuro MQ Mediumは当社で開発した神経細胞用培地で、iPS細胞由来神経細胞の成熟化を促進します。
その結果、従来培地よりも早期に活動電位の測定が可能となり、応用範囲が拡大しました。iPS細胞由来神経細胞だけでなく、その他の神経細胞にも
使用できます。血清は不含です。

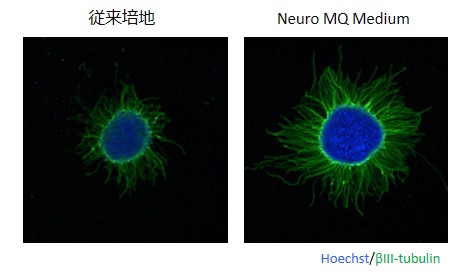
-神経突起形成の亢進-
iPS細胞由来神経細胞の神経突起形成が、従来の培地と比較して顕著に亢進されました。本試験では、ReproNeuroの細胞塊を接着培養に移行して、神経突起の形成を評価しています。
-MEAアッセイによる神経細胞活動の評価-
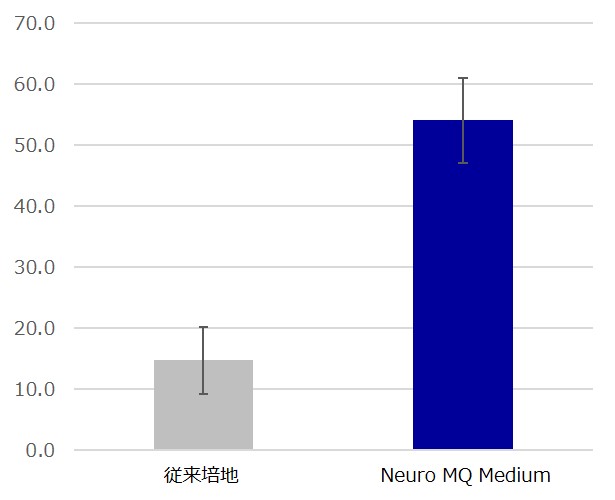
シグナルが検出できたチャネル数の増加
従来の培地と比較して、3倍以上の数のチャネルで神経細胞由来のシグナルの検出が可能となりました。この改善により、MEAアッセイでの試験が容易に実施できるようになります。
神経活動および成熟化の促進
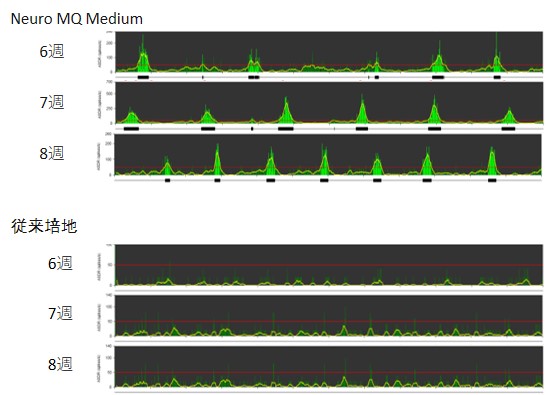
ReproNeuroを電極プレート上に播種し、神経細胞由来のシグナルを取得しました。
解凍・播種後、2週間目からシグナルは取得でき、6週目以降から同期バーストの回数が顕著に増加しました。

3)機能評価(機能的アッセイ)
◆細胞内カルシウムイメージング
ReproNeuro™を14日間培養し、カルシウム指示薬(Fluo-8)を取り込ませることにより、神経活動による細胞内カルシウムの濃度変化を観察することができます。ほぼすべてのiPS細胞由来神経細胞がグルタミン酸刺激により活性化されることが確認されました。
| 刺激前 | 100μM グルタミン酸添加後 |
| βIII-tubulin | βIII-tubulin |
Provided by Prof. Oka and Mr. Enya in Keio Univ.
◆MEAアッセイ
MEAアッセイは、非侵襲的に神経細胞の電気生理学的な活動を測定することで各種薬剤等に対する細胞の評価が可能です。iPS細胞由来心筋細胞においては、毒性試験分野で使用されてきましたが、近年は、iPS細胞由来神経細胞においても、毒性試験や薬効評価への応用が進められています。
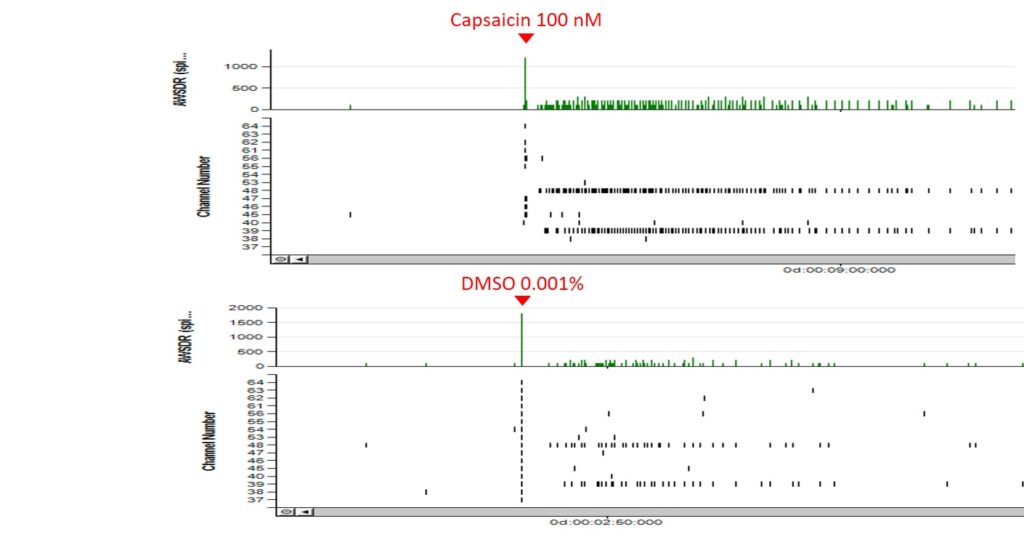
感覚神経細胞のカプサイシンへの反応
感覚神経細胞の反応性を評価する目的で、MEAを用いたカプサイシンへの反応性試験を実施しました。その結果、100 nMのカプサイシンを添加した場合(上図)は、コントロール(DMSO)を添加した場合(下図)と比較して、顕著に反応していることが確認されました。
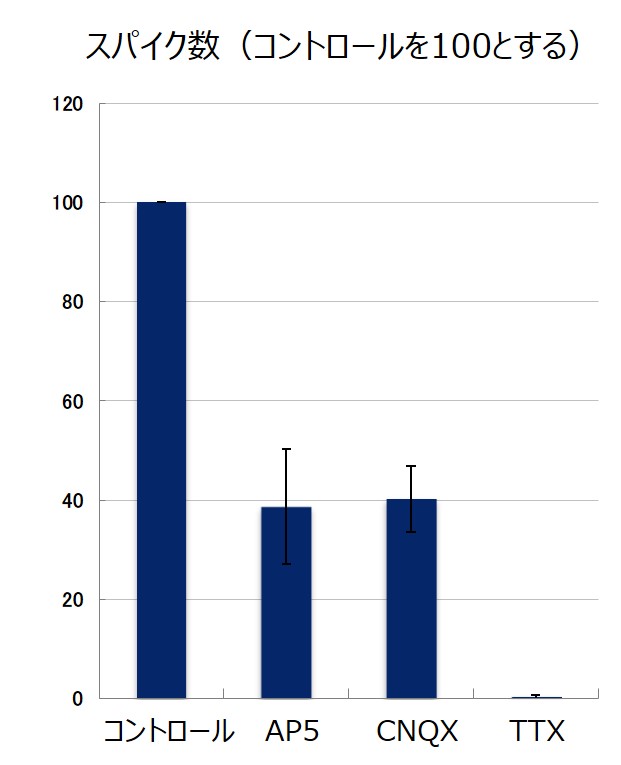
グルタミン酸受容体アンタゴニストへの反応
各種のグルタミン酸受容体のアンタゴニスト(APS, CNQX, TTX)による阻害効果が評されています。

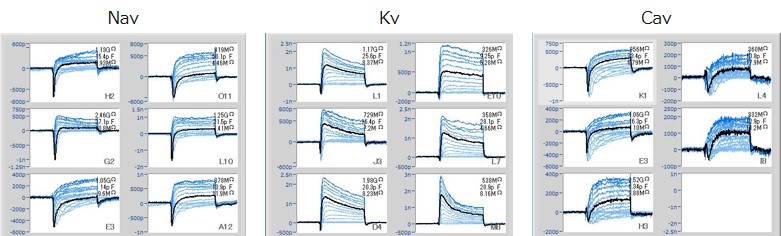
◆オートパッチクランプ
オートパッチクランプ(SyncroPatch384PE)を用いて、iPS細胞由来神経細胞の測定が可能です。ReproNeuroにおいて、Nav、Kv、Cav由来のシグナルが記録されており、各チャネルの発現が示唆されます。
4)疾患モデル細胞
様々な疾患に対して、iPS細胞由来の疾患モデル細胞を利用した研究が進められてきております。リプロセルグループでは、要望に合わせた疾患モデル細胞作製に必要な遺伝子編集サービスおよび患者リクルーティング、iPS細胞樹立等の受託サービスを承ります。

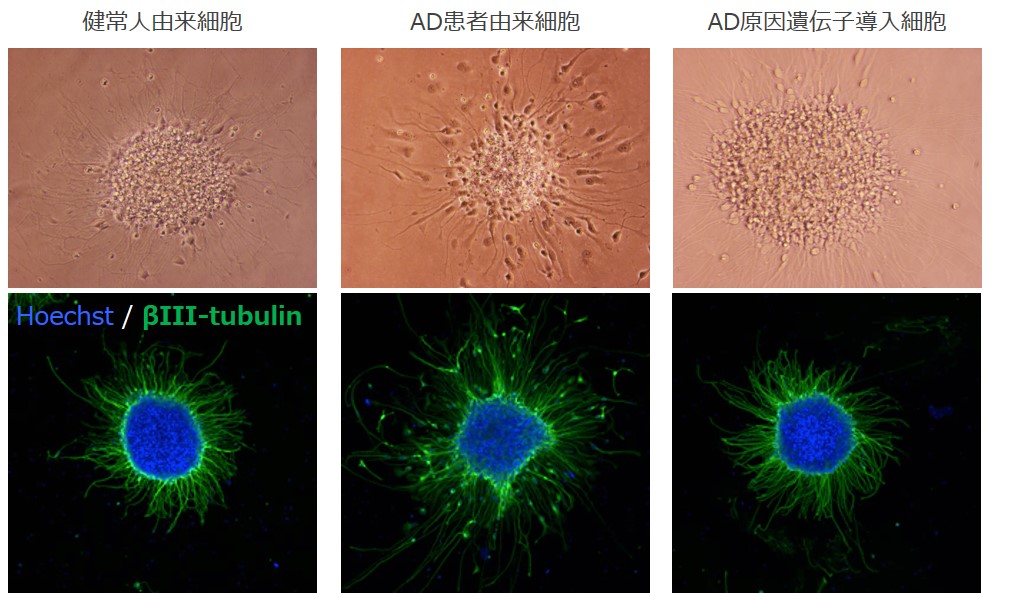
-神経突起の形成・伸長-
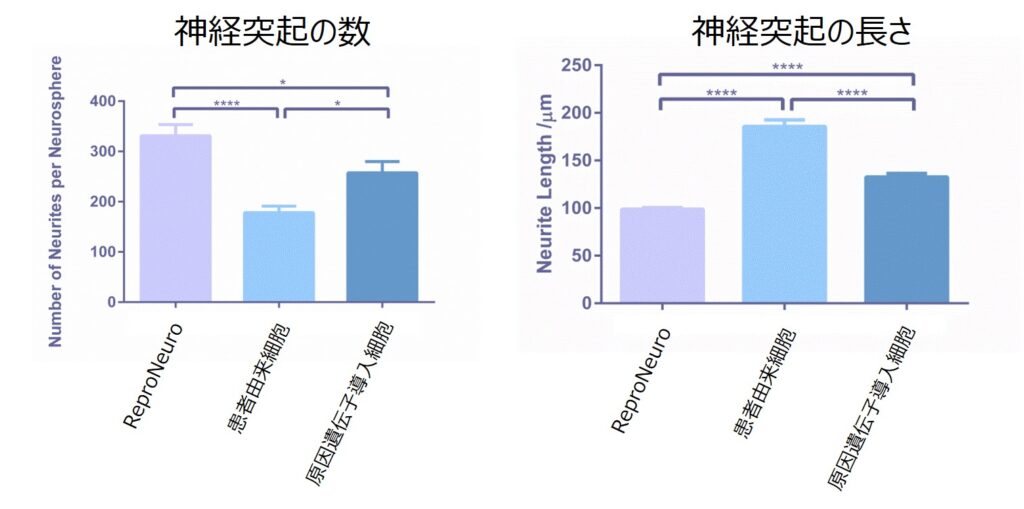
健常者由来細胞、AD患者由来細胞、AD原因遺伝子導入由来細胞を用いて、アルツハイマー病モデル細胞の表現型(神経突起形成・伸長)解析を実施した。AD患者由来神経細胞は、アルツハイマー病の原因遺伝子の一つであるPresenilin 2(PS2)に変異(R62H)を有するドナーからiPS細胞を作製し、神経細胞へと誘導された細胞で、AD原因遺伝子導入神経細胞は、アルツハイマー病の原因遺伝子であるPresenilin 1(PS1)の変異型(P117L)を遺伝子導入した細胞です。それぞれの細胞塊を作製してから、接着培養へと移行し、神経突起の本数・長さを蛍光染色画像を用いて測定しました。
上図:神経細胞の画像 下図:画像解析結果
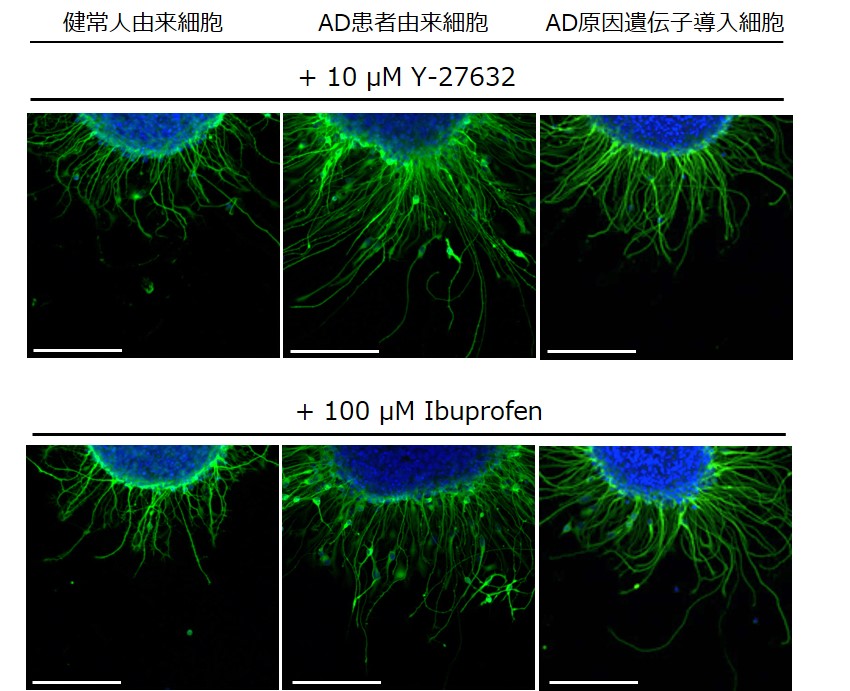
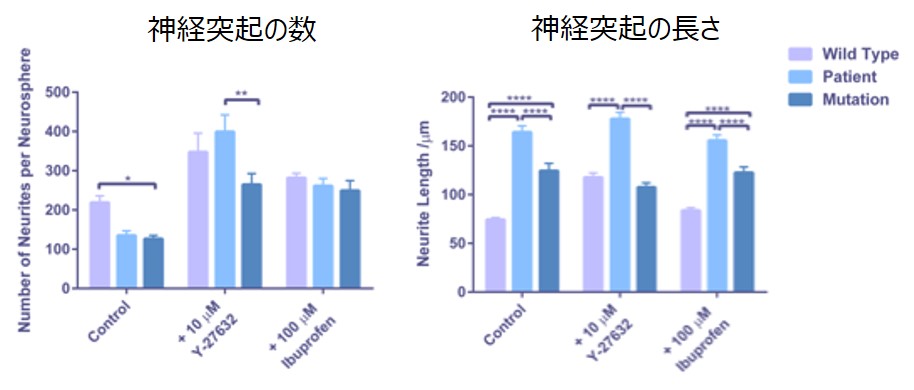
さらに突起形成に関連するシグナル系を明らかにすることを目的として、ROCKの阻害剤(Y-27632)とRho-Aの阻害剤(Ibuprofen)による神経突起伸長への影響を評価しました。それぞれの阻害剤の添加により、アルツハイマー病モデル細胞で起こっていた神経突起数の減少がレスキューされることが観察されています。このように、iPS細胞を利用したアルツハイマー病モデル細胞の表現型解析をすることで、多様な評価が可能となります。
上図:神経細胞の画像 下図:画像解析結果
-アミロイドベータの産生-
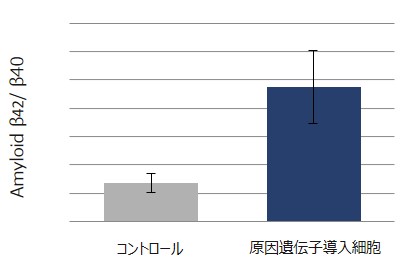
AD原因遺伝子導入細胞由来神経細胞を培養している培養外液のAβの濃度を測定した。コントロールと比較して、Aβ42の産生割合が増加することが確認できています。この結果は、アルツハイマー病の特徴的な性質を表現できており、アミロイド仮説に基づいた試験にご利用いただけます。
※当社はiPSアカデミアジャパン株式会社より、商用ライセンスを取得しております。
◆参考文献
- Saito A. Ohtani S, Wada K. Suzuki Y. Hattori K. Ushiyama A. Nakasono S. Real-Time Detection of Neuronal Network Activity Under 85 kHz Band High-Intensity Intermediate Frequency-Magnetic Field Exposure. URSI Radio Science Letters. 2022; Vol. 4.
- Ayabe T, Takahashi C, Ohya R, Ano Y. β-Lactolin improves mitochondrial function in Aβ-treated mouse hippocampal neuronal cell line and a human iPSC-derived neuronal cell model of Alzheimer’s disease. FASEB J. 2022;36(4):e22277. doi:10.1096/fj.202101366RR
- Saito M. Application of the Loewner Equation for Neurite Outgrowth Mechanism. Chaos Theory – Recent Advances, New Perspectives and Applications. 2022; Chapter 16.
- Murai Y, Honda T, Yuyama K, et al. Evaluation of Plant Ceramide Species-Induced Exosome Release from Neuronal Cells and Exosome Loading Using Deuterium Chemistry. Int J Mol Sci. 2022;23(18):10751. Published 2022 Sep 15. doi:10.3390/ijms231810751
- Gonzalez S, McHugh TLM, Yang T, et al. Small molecule modulation of TrkB and TrkC neurotrophin receptors prevents cholinergic neuron atrophy in an Alzheimer’s disease mouse model at an advanced pathological stage. Neurobiol Dis. 2022;162:105563. doi:10.1016/j.nbd.2021.105563
- Satoh M, Suzuki T, Sakurai T, et al. A Novel In Vitro Assay Using Human iPSC-Derived Sensory Neurons to Evaluate the Effects of External Chemicals on Neuronal Morphology: Possible Implications in the Prediction of Abnormal Skin Sensation. Int J Mol Sci. 2021;22(19):10525. Published 2021 Sep 29. doi:10.3390/ijms221910525
- Sugai A, Kato T, Koyama A, et al. Non-genetically modified models exhibit TARDBP mRNA increase due to perturbed TDP-43 autoregulation. Neurobiol Dis. 2019;130:104534. doi:10.1016/j.nbd.2019.104534
- Yang B, Mao J, Gao B, Lu X. Computer-Assisted Drug Virtual Screening Based on the Natural Product Databases. Curr Pharm Biotechnol. 2019;20(4):293-301. doi:10.2174/1389201020666190328115411
- Alhibshi AH, Odawara A, Suzuki I. Neuroprotective efficacy of thymoquinone against amyloid beta-induced neurotoxicity in human induced pluripotent stem cell-derived cholinergic neurons. Biochem Biophys Rep. 2019;17:122-126. Published 2019 Jan 3. doi:10.1016/j.bbrep.2018.12.005
- Snyder C, Yu L, Ngo T, et al. In vitro assessment of chemotherapy-induced neuronal toxicity. Toxicol In Vitro. 2018;50:109-123. doi:10.1016/j.tiv.2018.02.004
- Mukae Y, Itoh M, Noguchi R, et al. The addition of human iPS cell-derived neural progenitors changes the contraction of human iPS cell-derived cardiac spheroids. Tissue Cell. 2018;53:61-67. doi:10.1016/j.tice.2018.05.002
- Kimura J, Shimizu K, Kajima K, et al. Nobiletin Reduces Intracellular and Extracellular β-Amyloid in iPS Cell-Derived Alzheimer’s Disease Model Neurons. Biol Pharm Bull. 2018;41(4):451-457. doi:10.1248/bpb.b17-00364
- Kumagai A, Sasaki T, Matsuoka K, et al. Monitoring of glutamate-induced excitotoxicity by mitochondrial oxygen consumption. Synapse. 2019;73(1):e22067. doi:10.1002/syn.22067
- Murata H, Takamatsu H, Liu S, Kataoka K, Huh NH, Sakaguchi M. NRF2 Regulates PINK1 Expression under Oxidative Stress Conditions. PLoS One. 2015;10(11):e0142438. Published 2015 Nov 10. doi:10.1371/journal.pone.0142438
- Odawara A, Gotoh M, and Suzuki I. A three-dimensional neuronal culture technique that controls the direction of neurite elongation and the position of soma to mimic the layered structure of the brain” RSC Adv. 2013.
- Alhebshi AH, Odawara A, Gotoh M, Suzuki I. Thymoquinone protects cultured hippocampal and human induced pluripotent stem cells-derived neurons against α-synuclein-induced synapse damage. Neurosci Lett. 2014;570:126-131. doi:10.1016/j.neulet.2013.09.049
- Bottiglieri T, Arning E, Wasek B, Nunbhakdi-Craig V, Sontag JM, Sontag E. Acute administration of L-DOPA induces changes in methylation metabolites, reduced protein phosphatase 2A methylation, and hyperphosphorylation of Tau protein in mouse brain. J Neurosci. 2012;32(27):9173-9181. doi:10.1523/JNEUROSCI.0125-12.2012
 Global
Global