
パイプラインの状況
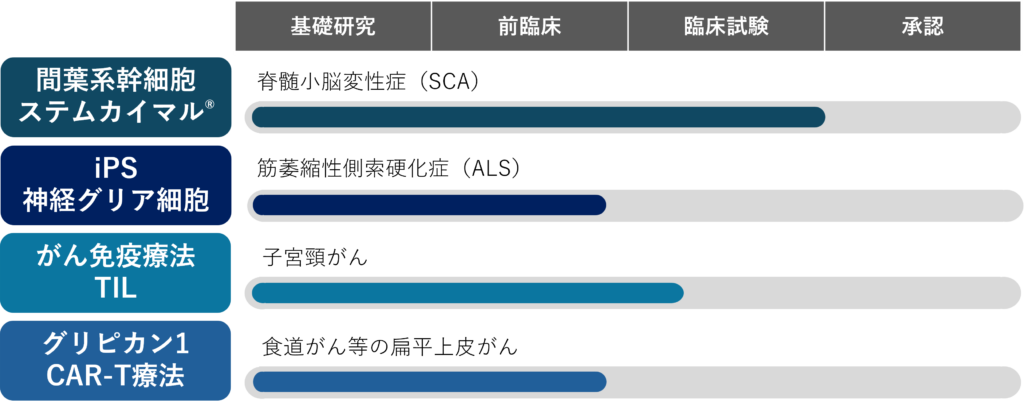
患者さん一人ひとりのための次世代医療の実現に向け、幹細胞・免疫細胞を用いた多様な治療法の研究開発を推進しています。
現在、脊髄小脳変性症に対する脂肪由来間葉系幹細胞製品「ステムカイマル®」、中枢神経疾患(ALS/TMなど)を対象としたiPS細胞由来神経グリア前駆細胞(iGRP)、さらにはがんに対する細胞免疫療法として、TIL療法およびグリピカン1-CAR-T療法をラインアップしています。これらの開発を通じて、新たな治療の選択肢となる治療薬の一日も早い実用化を目指しています。

脊髄小脳変性症の患者様へ
ステムカイマル®
ステムカイマル®は、Steminent Biotherapeutics社(台湾)が開発した再生医療製品です。
日本ではリプロセルが開発を行っており、患者様の元へ少しでも早くお届けできるよう、承認申請の準備を進めています。
ALS / TMの患者様へ
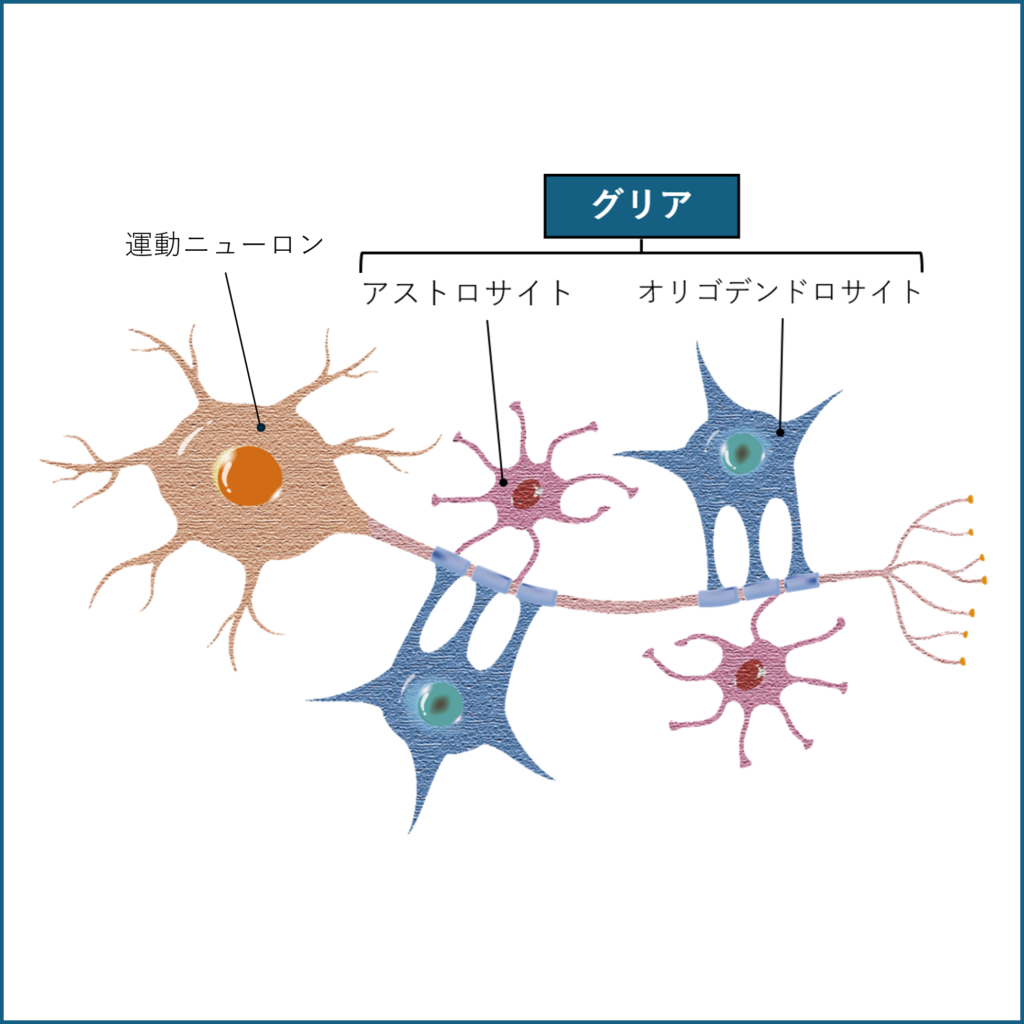
iPS細胞由来 神経グリア前駆細胞
ALSやTMなどの中枢神経系疾患に対する新たな治療戦略の取り組みとして、iPS細胞から神経グリア前駆細胞(iGRP)を作製し、臨床応用を目指す研究開発を進めています。 現在は前臨床試験を行っており、臨床試験に向けて準備を進めています。
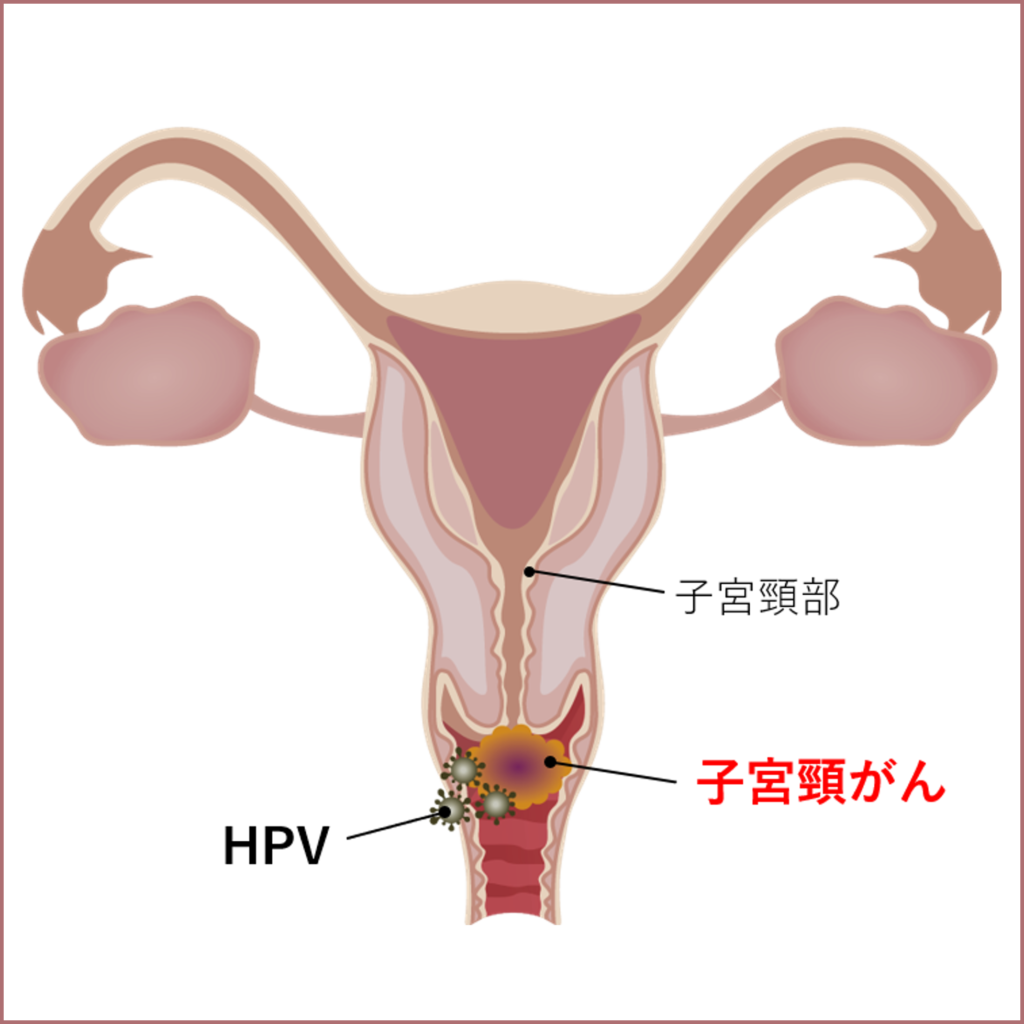
子宮頸がんの患者様へ
TIL療法 (腫瘍浸潤リンパ球輸液療法)
TIL療法は、患者自身のがん組織に含まれる腫瘍浸潤リンパ球(TIL)を採取し、体外で大量に培養した後、再び患者に戻す養子免疫療法の一種です。
TIL療法は、以前より進行悪性黒色腫に対して有効性を示しており、今後は子宮頸がんを対象としたさらなる開発を進めてまいります。
食道がん等の固形がんの患者様へ
グリピカン1・キメラ抗原受容体T細胞療法
グリピカン1・CAR-T療法は、患者様自身のT細胞(免疫細胞)を取り出し、固形がんを認識できるよう遺伝子改変を行い、再度患者様に投与して治療を行います。 従来のCAR-T療法は血液がんに有効でしたが、固形がんへの効果は限定的でした。本療法は、グリピカン1を標的とすることにより、固形がんに対する新たな治療効果が期待されます。

 Global
Global


