
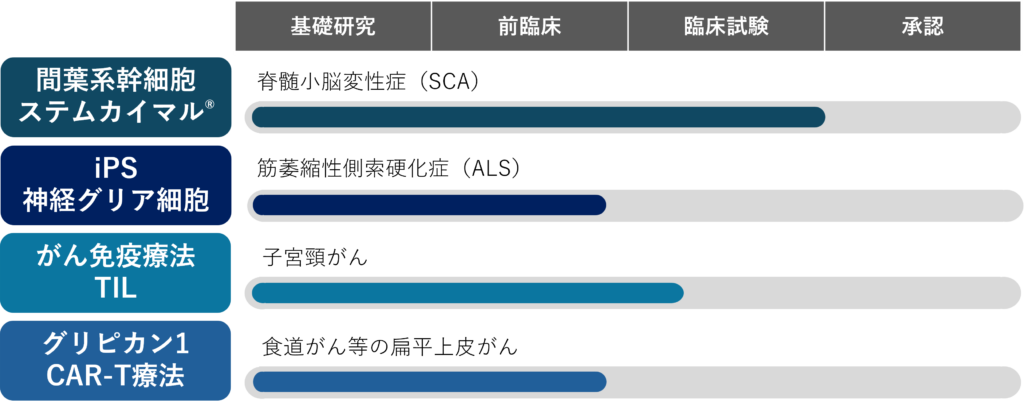
パイプラインの状況

脊髄小脳変性症の患者様へ
ステムカイマル®
ステムカイマル®は、Steminent Biotherapeutics社(台湾)が開発した再生医療製品です。
日本ではリプロセルが開発を行っており、患者様の元へ少しでも早くお届けできるよう、承認申請の準備を進めています。
ALS / TMの患者様へ
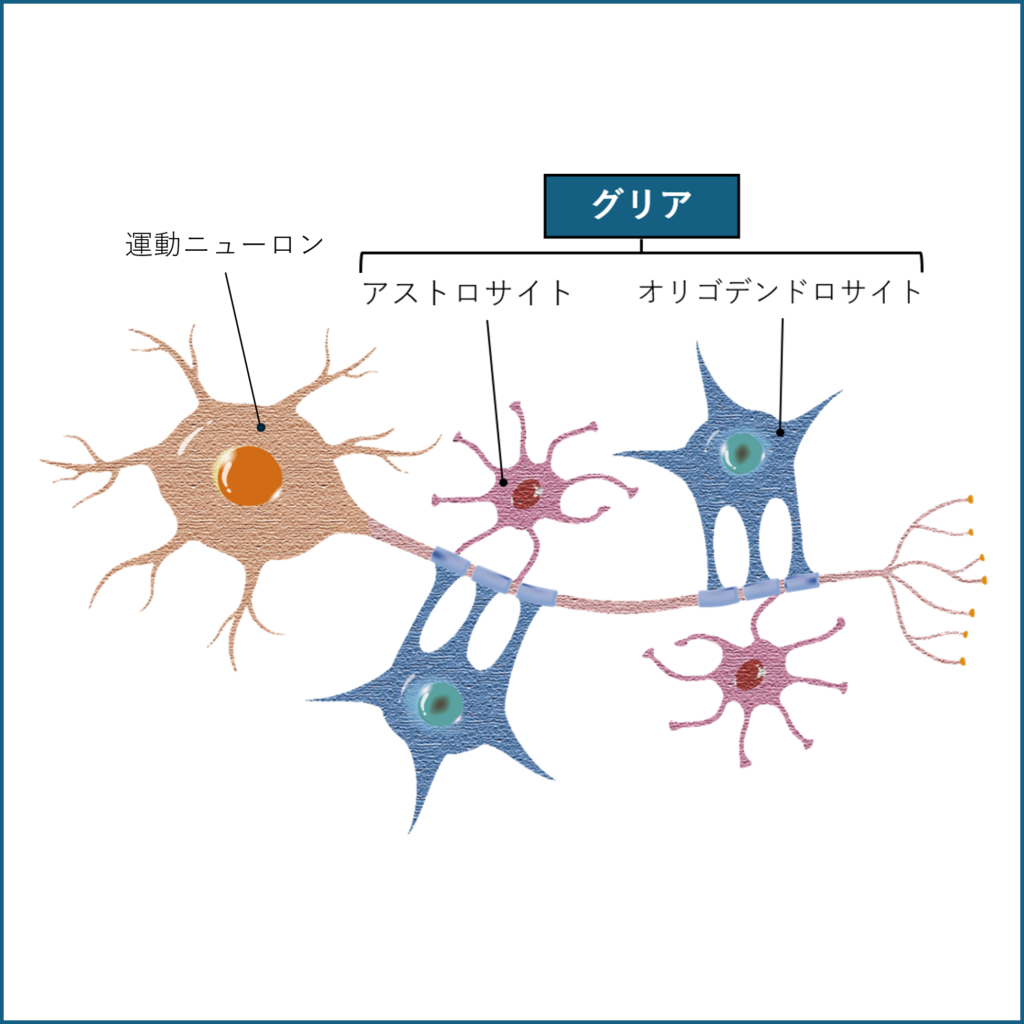
iPS細胞由来 神経グリア前駆細胞
ALSやTMなどの中枢神経系疾患に対する新たな治療戦略の取り組みとして、iPS細胞から神経グリア前駆細胞(iGRP)を作製し、臨床応用を目指す研究開発を進めています。 現在は前臨床試験を行っており、臨床試験に向けて準備を進めています。
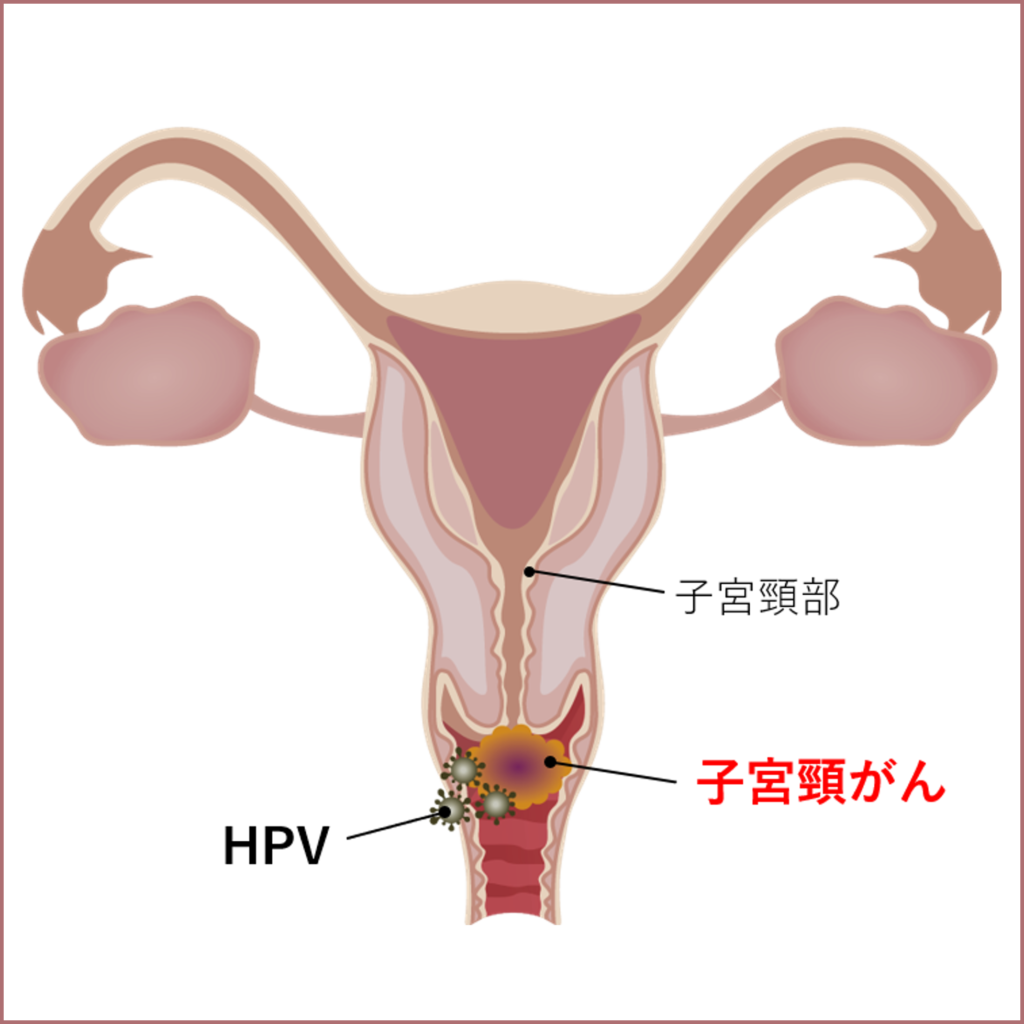
子宮頸がんの患者様へ
TIL療法 (腫瘍浸潤リンパ球輸液療法)
TIL療法は、患者自身のがん組織に含まれる腫瘍浸潤リンパ球(TIL)を採取し、体外で大量に培養した後、再び患者に戻す養子免疫療法の一種です。
TIL療法は、以前より進行悪性黒色腫に対して有効性を示しており、今後は子宮頸がんを対象としたさらなる開発を進めてまいります。
食道がん等の固形がんの患者様へ
グリピカン1・キメラ抗原受容体T細胞療法
グリピカン1・CAR-T療法は、患者様自身のT細胞(免疫細胞)を取り出し、固形がんを認識できるよう遺伝子改変を行い、再度患者様に投与して治療を行います。 従来のCAR-T療法は血液がんに有効でしたが、固形がんへの効果は限定的でした。本療法は、グリピカン1を標的とすることにより、固形がんに対する新たな治療効果が期待されます。

 Global
Global