
ネオアンチゲン同定サービス 「NeoSight(ネオサイト)」
がん免疫療法に用いられるネオアンチゲン
近年、がん免疫療法は治療の柱の一つとなりましたが、すべての患者さんに十分な効果が得られるわけではありません。その理由の一つは、患者さんごとに異なるがん細胞の標的(抗原)を正確に特定しきれていないことです。この課題を克服するために、ネオアンチゲンの利用が期待されています。
ネオアンチゲンとは、がん細胞に生じた遺伝子変異に由来するタンパク質の断片(ペプチド)で、免疫系が「自己ではない」と認識するものを指します。がんは遺伝子変異の蓄積を背景に発生し、その結果、正常な細胞にはない異常タンパク質が産生されます。これらが分解されて生じたペプチドがHLA分子に結合して細胞表面に提示されると、免疫細胞に”異物”として認識され、がん細胞が選択的に攻撃されます。
原則としてネオアンチゲンは腫瘍に特異的であるため、正常組織への影響を最小限に抑えながら、がん細胞のみを狙い撃ちできる優れた免疫療法の標的となります。ネオアンチゲンの同定は、腫瘍組織における体細胞変異の検出、変異タンパク質の発現確認、HLA分子への結合性と提示可能性の計算予測(必要に応じて実験的検証を含む)からなる一連のプロセスを経て行われます。同定されたネオアンチゲンは患者一人ひとりのがん細胞に固有の抗原であり、これを標的化することで、より個別化された(オーダーメイド)治療が可能となり、治療効果の向上が期待されます。
ネオアンチゲン同定サービス 「NeoSight(ネオサイト)」
ネオサイト
ネオアンチゲン同定サービス「ネオサイト」は、患者ごとの腫瘍の遺伝子情報を精密に解析し、各患者に固有のネオアンチゲンを特定するサービスです。ご提供いただく検体(腫瘍組織や血液など)から抽出したDNAおよびRNAを対象に、変異の同定、発現の確認、HLA型に基づくMHCへの結合性の予測までを一貫して実施します。得られた結果を統合し、変異ペプチドの生成とMHC分子による提示の可能性を評価することで、個別化治療に資する候補ネオアンチゲンを予測します。
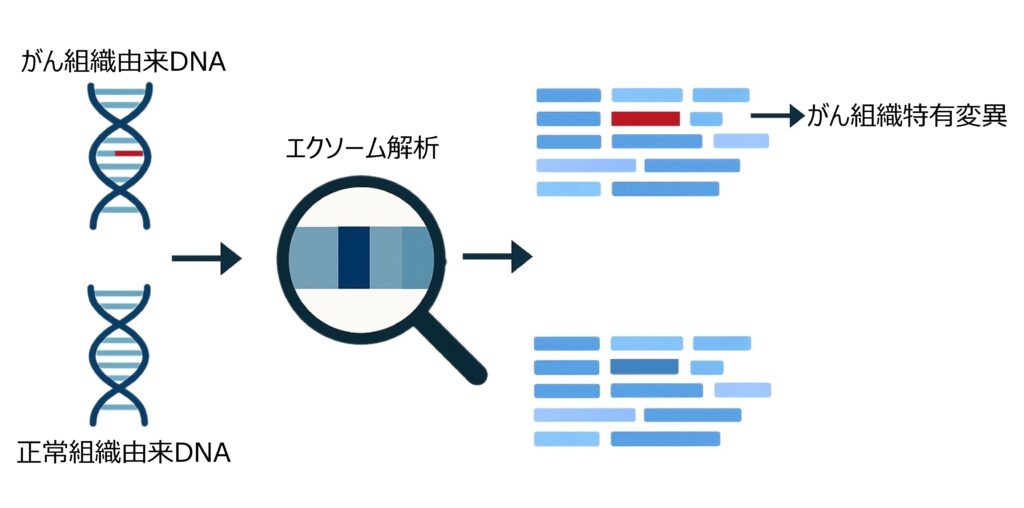
全エクソームシーケンス(WES)による腫瘍特異的体細胞変異の同定
次世代シーケンスを用いて、腫瘍組織と血液のペアサンプルに対し全エクソームシーケンスを行い、腫瘍特異的な体細胞変異(がん細胞にのみ生じた遺伝的変化)を高精度に同定します。
RNAシーケンシング(RNA-Seq)による遺伝子発現の確認
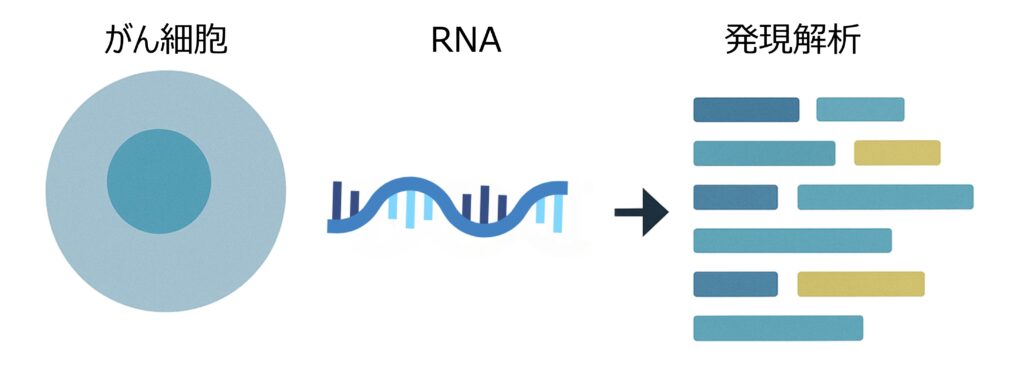
WES等で同定した体細胞変異について、その転写産物が実際に発現しているかを検証し、評価します。実際に発現している変異由来ペプチド(ネオアンチゲン)候補を絞り込み、発現レベルや生物学的妥当性に基づく優先順位付けを行います。
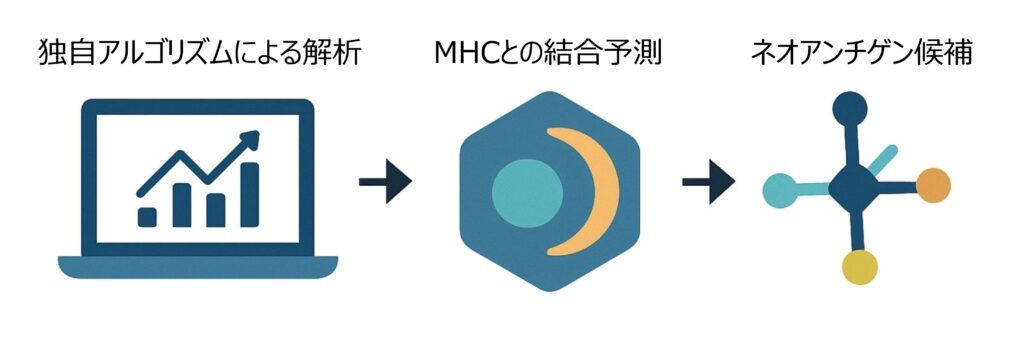
最適化アルゴリズムによるMHC結合性の高いネオアンチゲンの同定
HLA遺伝子型と最適化アルゴリズムに基づき、変異由来ペプチドのHLA(MHC)分子への結合能を予測します。解析結果を集約し、腫瘍特異性と免疫学的妥当性の高いネオアンチゲン候補(20~50個)を順位付けして提案します
ネオサイト (NeoSight)のワークフロー
ステップ1.患者サンプル(腫瘍組織、血液等)の受取

ステップ2.患者サンプルからDNA/RNA抽出

ステップ3.全エクソーム解析(腫瘍+正常)およびRNA-seq

ステップ4.体細胞変異の検出、発現解析、HLAタイピング

ステップ5.HLA結合能に基づく候補ネオアンチゲンの順位付け

オプション.GMPグレードのペプチド(ネオアンチゲン)合成
レポート内容
●結合親和性予測に基づき優先順位付けされたネオアンチゲンリスト
※予測される結合強度、発現量、その他のフィルターに基づいて、最適なネオアンチゲン候補をランク付けしたリストです。
●アノテーション付きバリアントファイル(VCF, TSV)
※すべての腫瘍変異を一覧化し、ゲノム上の位置と遺伝子機能/タンパク質への影響を示します。
●HLAタイピングと結合親和性スコア(MHCクラスIおよびII)
※患者のHLAタイプを特定し、それぞれの変異由来ペプチドがHLAにどれだけ強く結合するかを予測します。
●腫瘍変異負荷(TMB)レポートと変異スペクトラム
※全体的な変異の量と、存在する変異の種類を測定します。
●レポート概要
※手法、結果、および主要な所見をまとめた簡潔なレポートです。
ネオサイト (NeoSight)の応用分野
免疫療法の開発 (Immunotherapy development)
腫瘍特異性が高く免疫原性に優れるペプチドを同定します。これにより抗原選択の精度が向上し、TCR-TやNeoTIL(ネオTIL)などのT細胞療法の設計・最適化を加速します。
個別化ワクチン設計 (Personalized vaccine design)
がん細胞に限定的で高免疫原性なネオアンチゲンを予測・優先順位付けし、患者ごとに最適化されたオーダーメイドがんワクチンの設計を支援します。強力で標的性の高い免疫応答の誘導が期待できます。
コンパニオン診断バイオマーカー研究 (Companion diagnostic biomarker studies)
免疫療法の奏効予測に資するバイオマーカーの探索・開発を支援します。腫瘍の免疫原性や変異由来エピトープを体系的にプロファイリングし、免疫チェックポイント阻害薬や個別化アプローチの恩恵を受けやすい患者の同定に貢献します。
イムノオンコロジー研究と臨床試験 (Immune-oncology research and clinical trials)
包括的なネオアンチゲン・プロファイリングは、トランスレーショナルリサーチを促進し、層別化された臨床試験デザインを支援します。腫瘍免疫の全体像(tumor immune landscape)について実践に活かせる知見を提供し、研究者がネオアンチゲン負荷と治療効果を関連付けて評価できるよう後押しします。
患者層別化と治療反応予測 (Patient stratification and response prediction)
腫瘍特異的ネオアンチゲンの量、発現、MHC提示可能性に基づき患者を層別化し、プレシジョン・オンコロジー(個別化がん治療)の実装を支援します。これにより反応予測の精度が高まり、治療計画の最適化や治験適格患者の選定に寄与します。
FAQ (Frequently Asked Questions)
·どのような種類のがんを解析できますか?
肺がん、大腸がん、乳がん、卵巣がん、メラノーマ(悪性黒色腫)、消化器がんなど、すべての固形がんに対応しています。十分な量の腫瘍組織と、それに対応する正常DNAをご提供いただければ、ほぼすべてのがん種で解析が可能です。
·正常サンプルなしで腫瘍サンプルのみを送ることはできますか?
可能ですが、腫瘍サンプルのみの解析では体細胞変異の検出精度に限界があります。
·HLAタイピングの結果がない場合、タイピングもお願いできますか?
はい、承っております。
·サンプルにはどのような品質管理(QC)が行われますか?
シーケンシングの前に、RNAの品質(インテグリティ)およびDNAの品質管理(濃度、純度)を実施します。品質が基準に満たないサンプルが確認された場合は、次の工程に進む前にお客様にご連絡し、ご相談させていただきます。
参考文献
- Ott, P. A., Hu, Z., Keskin, D. B., Shukla, S. A., Sun, J., Bozym, D. J., … & Wu, C. J. (2017).
An immunogenic personal neoantigen vaccine for patients with melanoma.
Nature, 547(7662), 217–221. - Schumacher, T. N., & Schreiber, R. D. (2015).Neoantigens in cancer immunotherapy.
Science, 348(6230), 69–74. - Chan, T. A., Yarchoan, M., Jaffee, E., Swanton, C., Quezada, S. A., Stenzinger, A., & Peters, S. (2019).
Development of tumor mutation burden as an immunotherapy biomarker: utility for the oncology clinic. Annals of Oncology, 30(1), 44–56. - Tran, E., Turcotte, S., Gros, A., Robbins, P. F., Lu, Y. C., Dudley, M. E., … & Rosenberg, S. A. (2014). Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science, 344(6184), 641–645.
 Global
Global
