脊髄小脳変性症に対する間葉系幹細胞由来細胞医療
ステムカイマル®
ステムカイマル®はSteminent Biotherapeutics Inc.(本社:台湾台北市、以下、ステミネント社)が開発しました。健常者ドナーより採取した脂肪組織から間葉系幹細胞を取り出し、さらに増殖させて製造します。最終的に生理食塩水で希釈し、点滴で投与する再生医療製品です。
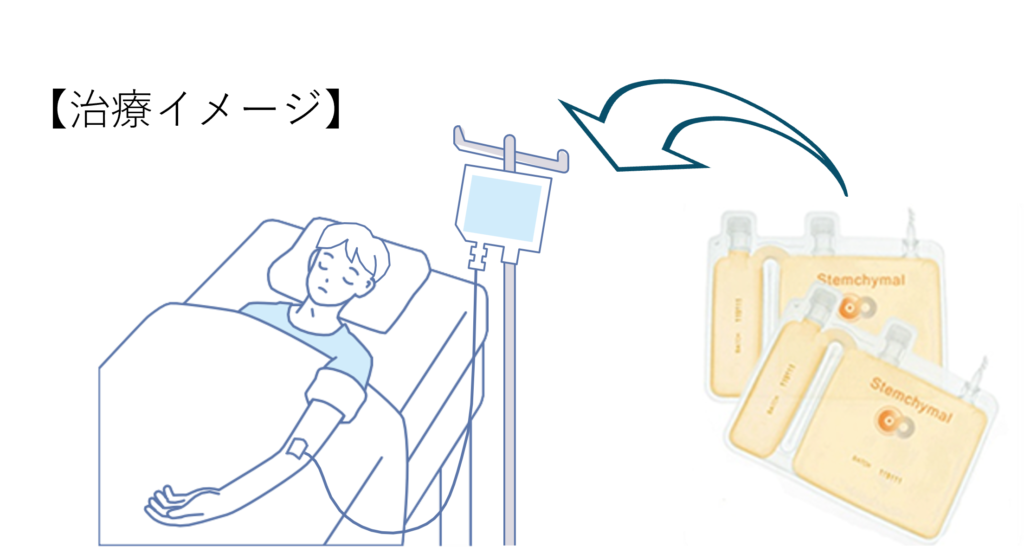
細胞懸濁液を生理食塩水に希釈して、静脈に投与します。
作用機序
パラクリン効果
増殖因子やサイトカインの放出
免疫調節
抗炎症効果
分化能
分化による損傷した組織の修復
ステムカイマルに係わる国内特許2件成立済み
■ポリグルタミン病治療組成物 (特許7406251)
■ポリグルタミン病の治療 (特許7462974)
ステムカイマル®の機能として、増殖因子やサイトカインの放出といったパラクリン効果、抗炎症効果といった免疫調節、そして損傷した組織の修復といった分化能の3つの役割が考えられています。
適応疾患
脊髄小脳変性症
脊髄小脳変性症は小脳や脳幹、脊髄の神経細胞が変性してしまう事により徐々に歩行障害(ふらつく、まっすぐ歩けない)や嚥下障害(うまく食べ物が飲み込めない)、言語障害(ろれつが回らない)などの運動失調が現れ、日常の生活が不自由となってしまう原因不明の疾患です。
本邦において、脊髄小脳変性症は厚生労働省難治性疾患克服研究事業に特定疾患として指定され、国内患者数は約3万人(約4,000人に1人)の希少疾患であり、20歳前後から60歳前後まで幅広い年齢で発病することが知られています。
脊髄小脳変性症に対する根治療法は現在までに確立されておらず、臨床症状の長期的な進行抑制効果を有する新薬の開発が望まれています。
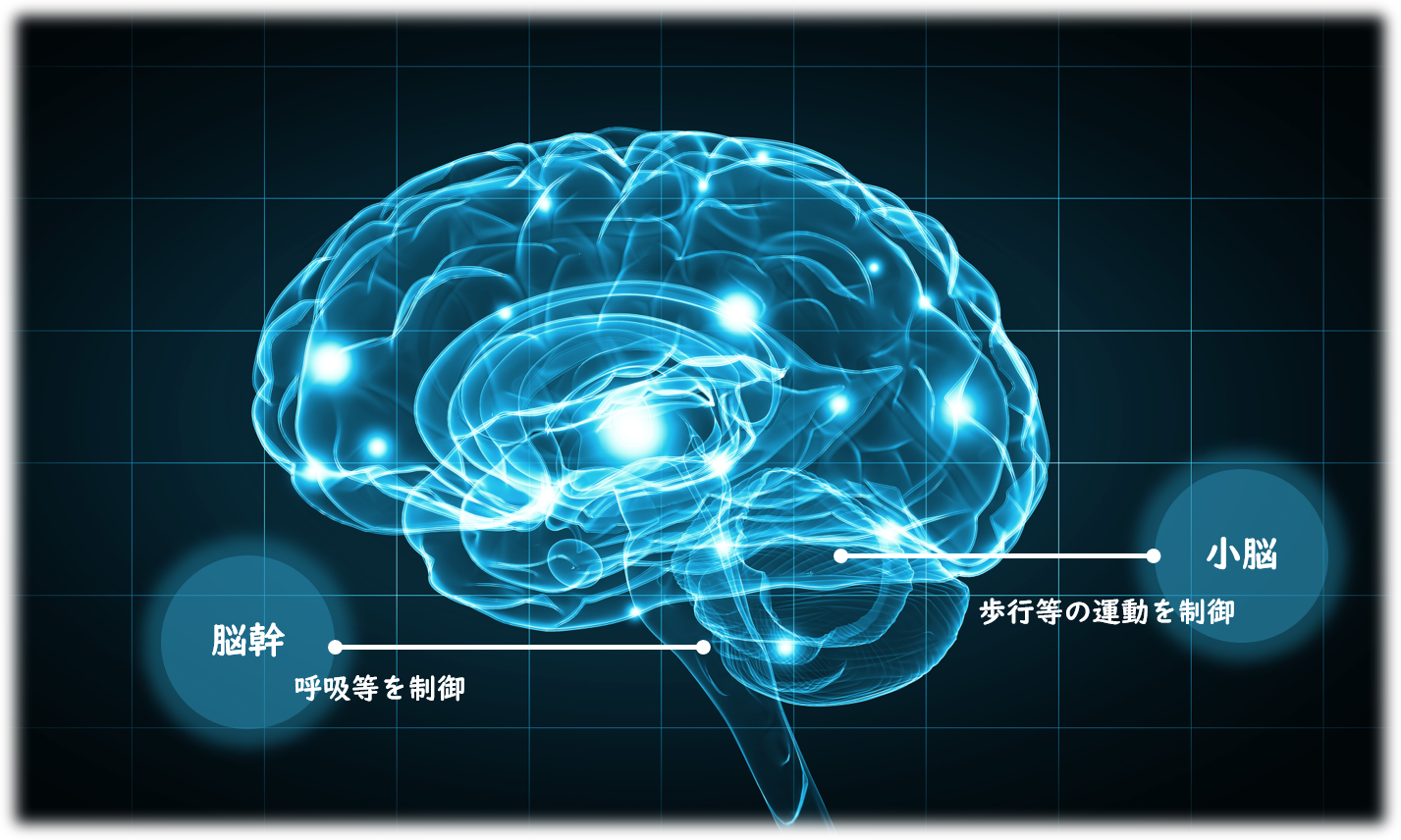
国内患者数 約3万人(約4千人に1人)
開発状況
ステムカイマル®の開発は日本、台湾、米国、韓国でグローバルに展開しております。日本ではリプロセルが独占的に開発を行っており、台湾と米国はステミネント社が主導しています。韓国ではSCM Life science社が独占的に開発を行っています。

日本の開発状況
■ 第II相臨床試験
脊髄小脳失調症3型(SCA3)と同6型(SCA6)の日本国内の患者さんを対象とした、ステムカイマル®を用いた第Ⅱ相臨床試験を実施しました。
安全性に関して、全被験者において重篤な有害事象は認められず、安全性が確認されております。有効性評価を、主要評価項目であるSARAスコア※1で実施したところ、実薬群のSARAスコアの上昇が自然歴と比較して抑制されていることが確認できました。さらに、ベースライン(Visit2、投与前)から52週目(Visit8)までの変化量の統計解析を実施した結果、ベースライン11以上の部分集団で、実薬群がプラセボ群と比べて統計的に有意に改善する結果となりました(p=0.042)。
また、ステムカイマル®に係わる特許も国内で成立しております。
当社では、病気と闘っている患者様へ少しでも早く新しい治療法が届けられるよう、承認申請の準備を進めております。
本治験の情報はJRCTに掲載されています(jRCT2043190090)。
お問い合わせは、当社問合せフォームにてお願いいたします。
■オーファンドラッグ※2に指定
ステムカイマル®は、厚生労働大臣の承認を得て希少疾病用再生医療等製品に指定されています。これにより、開発助成金や税制措置、優先審査等の支援措置を国から受けられることとなりました。
■ステミネント社、再生医療等製品外国製造業者※3に認定
ステミネント社は、厚生労働省厚生労働大臣より再生医療等製品外国製造業者に認定されています。本認定は、今後の製造販売承認の重要な要件となります。
※1 SARAスコア:脊髄小脳変性症の症状の評価に広く用いられている指標であり、歩行、立位、会話、指先の運動などを総合的に数値化します。0~40点の範囲で、症状が悪化するほどスコアは増加します。
※2 オーファンドラッグ:希少疾病用医薬品とも呼ばれ、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下「医薬品医療機器法」という。)第77条の2に基づき、対象患者数が本邦において5万人未満であること、医療上特にその必要性が高いもの、対象疾病に対し当該医薬品を用いる根拠があり開発計画が妥当であること、などの条件に合致するものとして、薬事・食品衛生審議会の意見を聴いて厚生労働大臣が指定するものです。
※3 再生医療等製品外国製造業者:外国において日本に輸出される再生医療等製品を製造しようとする者を、医薬品医療機器法における再生医療等製品外国製造業者といい、 国内製造業者の許可と同様に、外国製造業者が医薬品医療機器法第23条の24による認定を受けていることが当該再生医療等製品の製造販売承認の要件となっています。
海外の開発状況
■ 台湾、第II相臨床試験が終了
ステミネント社では、台湾及び米国でも脊髄小脳変性症を対象とした臨床開発を進めています。
まず、台湾では第I/IIa相臨床試験を実施し、ステムカイマル®の単回投与の安全性を確認するとともに、有効性を示唆するデータを取得しました。続いて、3回投与の安全性と有効性を確認する第II相臨床試験を実施しました。
本試験における安全性の問題はなく、また、実薬群 のSARAスコアの上昇が自然歴と比較して抑制されていること、さらに、ベースラインの高い部分集団においてSARA スコアの変化量に関する解析で、プラセボ群に対して実薬群で改善効果が認められております。これらの結果は日本の結果と類似しており、日本のデータを裏付けるものとなりました。
■ 米国、第II相臨床試験のIND承認およびオーファンドラッグ指定
米国では、第II相臨床試験に関する治験計画届(IND)の食品医薬品局(FDA)による審査が完了しています。ステムカイマル®はFDAより希少疾患向け医薬品等の開発を促進するオーファンドラッグ指定を受けています。
ステミネント社

ステミネント社は第II相臨床試験中の幹細胞製品を開発および製造するバイオテクノロジー企業です。本社は台湾の台北市に位置し、米国と中国にも支社を構えています。ステミネント社が有する独自技術プラットフォームにより製造されるステムカイマル®の製造管理および品質管理はPIC/S GMP等の関連ガイドラインに準拠しています。当社はステミネント社と日本における独占的共同開発および販売に関する契約を締結しています。
ウェブサイト:http://www.steminent.com/
 Global
Global
