
ヒト組織アッセイの紹介動画(YouTube)
|
|
■ ヒト組織アッセイ
(1) 創薬開発におけるヒト組織アッセイの意義
新薬の開発において、最終段階まで進んだ候補物が治験にてドロップアウトすることは、それまでに費やした多額の研究開発費用や多くの労力を無駄にすることになってしまうことから最も避けたいことの一つである。また、近年は従来の研究手法だけでは発見できない新薬の開発が望まれている。これらの点を目的として、創薬開発において新鮮なヒト組織の有効利用に注目が集まっている(1)。
これまでに用いられてきた不死化細胞を用いたスクリーニングアッセイや動物実験に基づいた新薬開発の結果、多くのブロックバスターとなる薬が生み出されてきた。このような試験はスループット性やコストの観点から、従来の創薬研究では主流であったが、不死化細胞では十分な機能性を有していないことや動物実験で生じる種差が課題であった。例えば、冠動脈におけるセロトニンに対する反応性は、ヒトとイヌでは大きく異なることが知られている(図1)。ヒト組織アッセイは、従来用いられてきた創薬研究と臨床試験とのギャップを埋めることを目指して、主に創薬開発プロセスにおいて前臨床段階で使用されている(図2)。開発初期のスクリーニングでは、高いスループット性が必要であるため新鮮なヒト組織を利用することは難しいが、ヒト組織を利用することで、候補薬剤の数が絞られてから臨床試験を開始する前に精度の高いデータを得ることが可能であり、それらのデータは次のステップへ進むかどうかの判断材料として利用される。ヒト組織を利用する意義は、単純な不死化細胞に対して機能面で優位性を保ち、種差による影響を気にする必要のないデータを得ることができ、従来の手法だけでは評価できなかった安全性や薬物動態、薬効の評価が可能になることである。さらに、ヒト組織アッセイは、前臨床試験だけでなく、治験で起こった予期せぬ副作用の機序の解明にも利用されている。
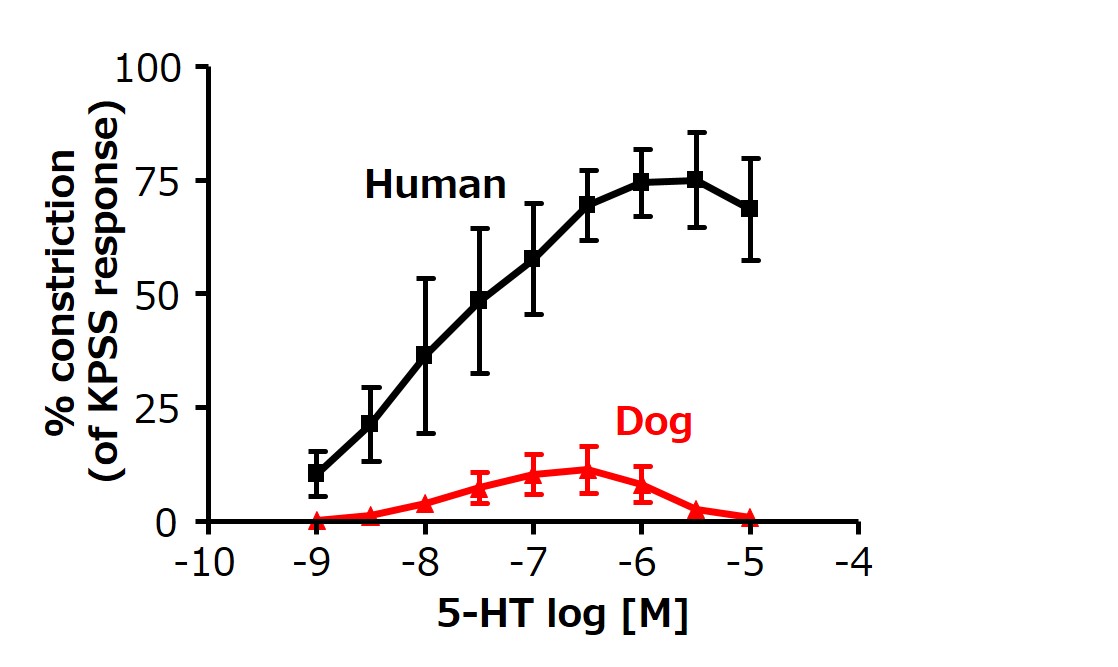
図1.種差が存在する例(セロトニンに対する冠動脈収縮反応)
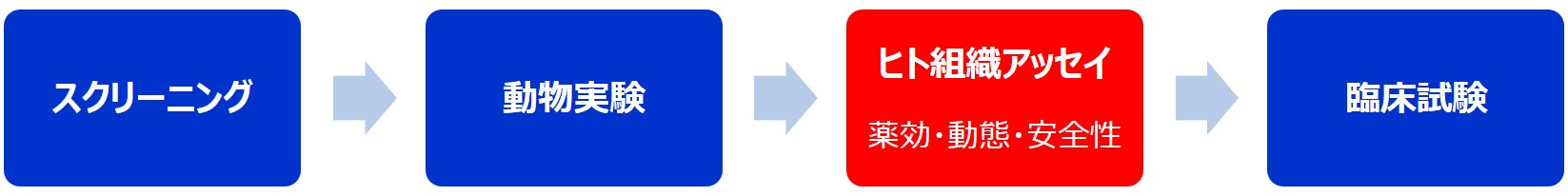
図2.ヒト組織アッセイの使用ステージ
(2) ヒト組織アッセイの流れ
ヒト組織アッセイでは、適切な組織を入手するルートや組織を取り扱う技術が必要となるため、現在でも十分に実施されている状況ではない。リプロセルグループではGLP対応試験が実施可能な施設・組織を有しており、15年以上に渡り、スコットランド、アメリカにおいてヒト組織アッセイを受託試験として行っている。ヒト組織は、手術の残余組織や移植不適合組織、生検組織を適切な倫理プロセスを経て取得している。得られた新鮮な組織は速やかに実験室に搬送され、各種試験に使用可能な形態へと調製後、各組織が本来の機能を有している間に試験に提供される(図3)。使用される機器は、Organ baths, Wire Myographs, Perfusion Myographs, Ussing Chanbers等が挙げられる(図4)。下記に、実際に新鮮なヒト組織を用いた各種試験(薬効評価、薬物動態評価、安全性評価)を紹介する。

図3.ヒト組織アッセイの流れ

図4.ヒト組織アッセイいに用いられる機器
(3) 薬効評価
ヒト組織を使うことのメリットの一つは、患者由来の試料を使用できることにもある。これまでに、喘息やCOPD(Chronic obstructive pulmonary disease)、動脈硬化症患者からの組織が使用されてきており、近年ではIBD (Inflammatory Bowel Disease) 患者由来腸組織のニーズが高まってきている。
・IBD(クローン病・潰瘍性大腸炎)
IBDは一般的にはクローン病と潰瘍性大腸炎を指し、これらの患者由来の腸組織は、開発薬剤の薬効評価を目的とした試験に使用される。患者から採取した腸組織はインサート上で18~24時間程度の培養が可能であり(図5)、培養された組織では、疾患に特有のサイトカインの発現パターンが維持されていることが確認されている。さらに患者由来の腸組織に、プレドニゾン(Prednisone)または、MAPK 阻害剤(BIRB796)を添加後の、TNF-alfa濃度の測定(図6)やその他のインターロイキン(IL)の測定が実施されている。
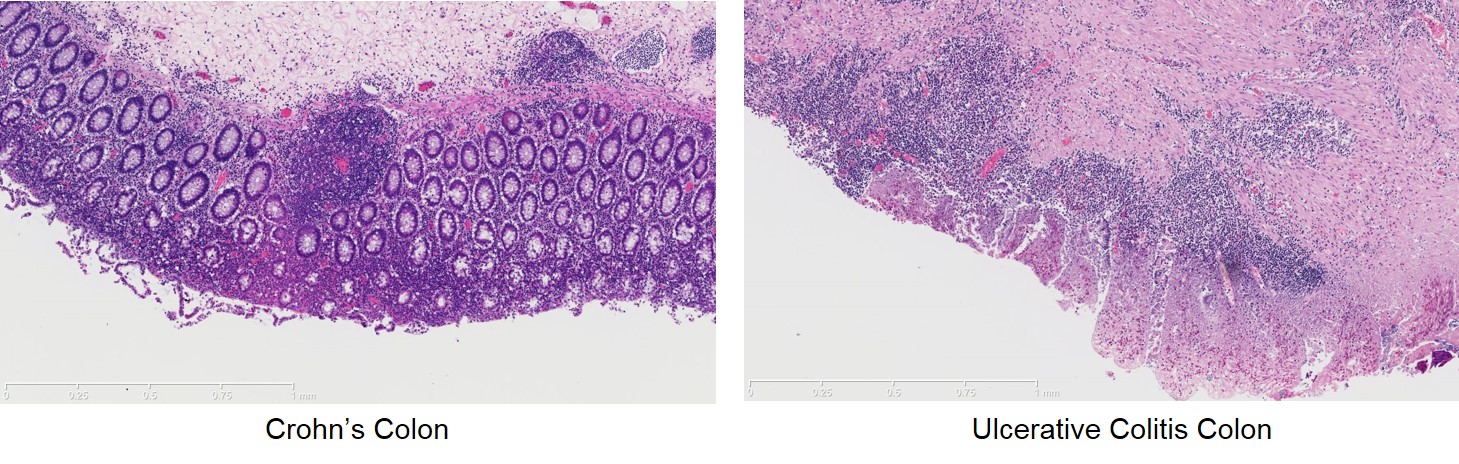
図5.IBD患者(クローン病、潰瘍性大腸炎)由来の腸組織
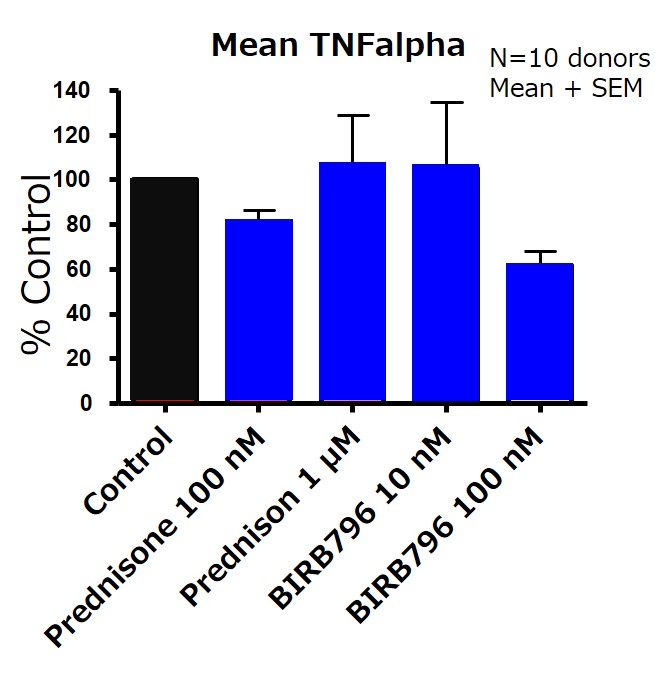
図6.IBD患者由来の腸組織を用いたアッセイ例
・皮膚(乾癬・アトピー)
皮膚組織も、図7の様なインサートを用いた培養が一般的である。培養された皮膚組織は、10日程度は概ね正常な構造を維持したまま培養が可能である(図8)。これらの組織は表皮だけでなく、真皮や免疫細胞も保持していることから、炎症反応に特有なサイトカインの発現や分泌が評価可能である。健常人由来の皮膚組織にLPS(Lipoplusaccharide)およびDexametazone, Triamcinoloneを添加し、複数のILを測定した結果を例として挙げる(図9)。乾癬患者由来の皮膚の取得も可能であり、遺伝子発現や免疫組織化学的な解析が可能である。
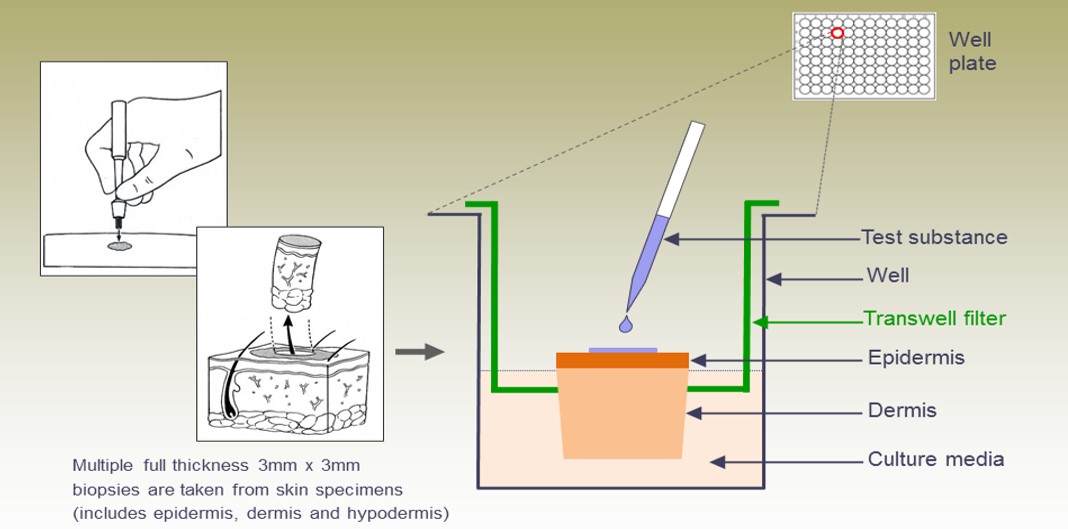
図7.皮膚組織の培養方法
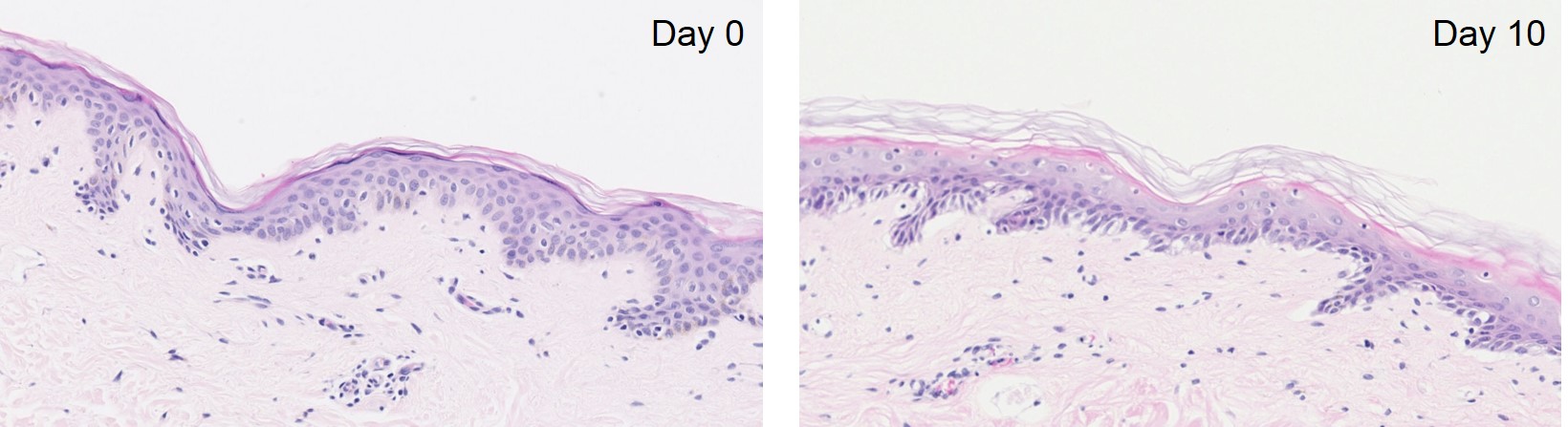
図8.培養された皮膚組織
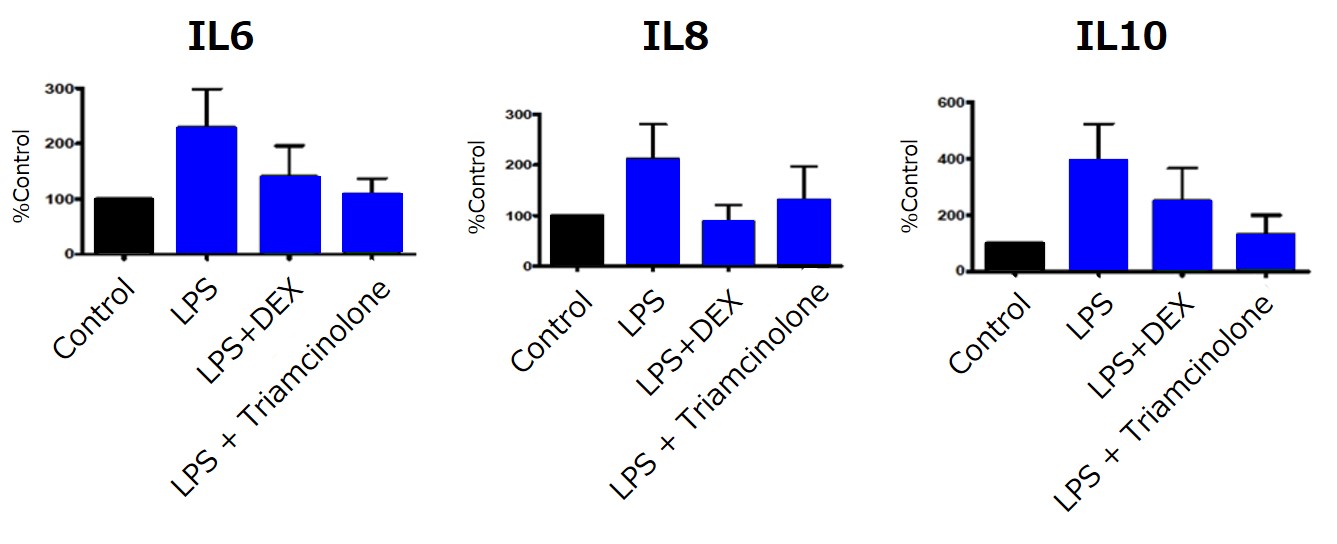
図9.健常人の皮膚組織でのサイトカイン測定
(4) 薬物動態評価
薬物動態の評価は主に腸組織を用いて実施されているが、その他にも皮膚や胃粘膜も用いられる。特に、近年は小腸における透過性だけでなく、代謝性も重要であることが注目されている。これまでに用いられてきた実験動物では、吸収能は比較的ヒトと似た傾向を示していたが、代謝能は種差が大きいことが知られており、より正確なヒト体内での動態評価のために、ヒト組織の利用が望まれている。具体的な手法としては、ヒト小腸とUssing Chambersを用いた、試験が実施されている(2)。
・小腸
Ussinng Chambersは二つの水槽が連結されており、その間に挟まれた膜として小腸、膀胱等(図10の赤い部分に新鮮なヒト組織をセット)を使用することで、膜を介した物質輸送や使用した組織での代謝性が評価できる。特に創薬プロセスにおいては、小腸が多く使用されており、各種候補化合物の透過性、代謝性、トランスポーターを介した輸送性等の評価を実施している。小腸で発現している代表的なトランスポーターであるP-glycoprotein(P-gp)を介したジゴキシンの双方向での排出データを図11に示す。基底膜側から管腔側への排出能がみとめらている。
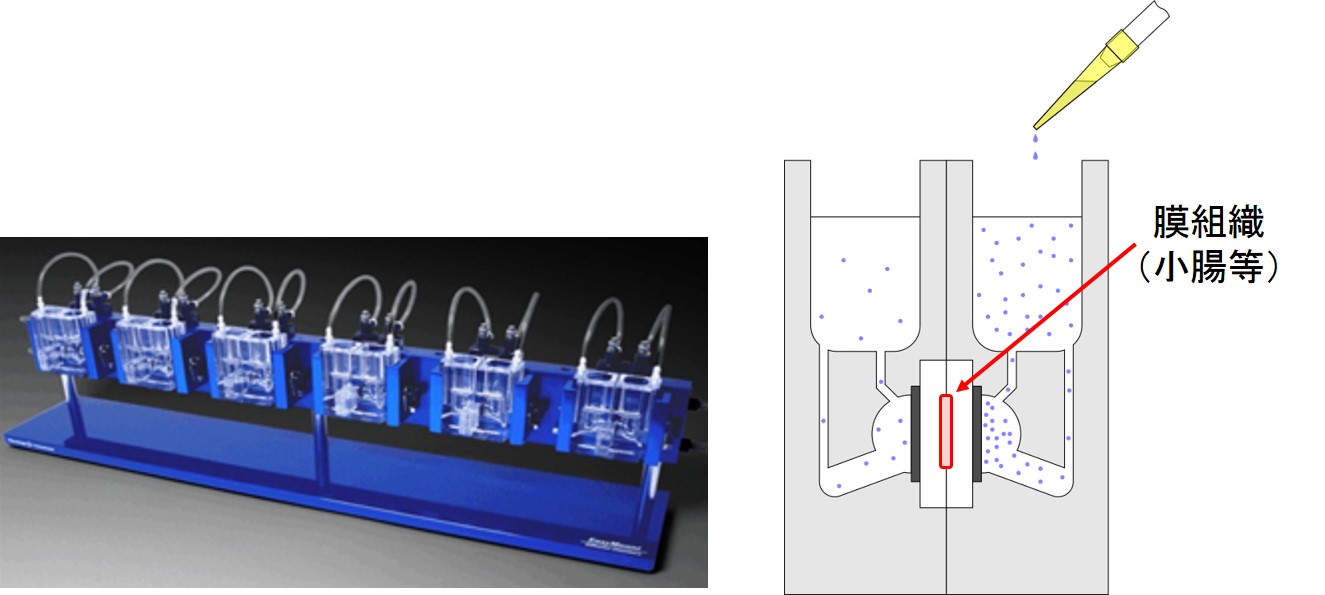
図10.Ussing chambers(左)と模式図(右)
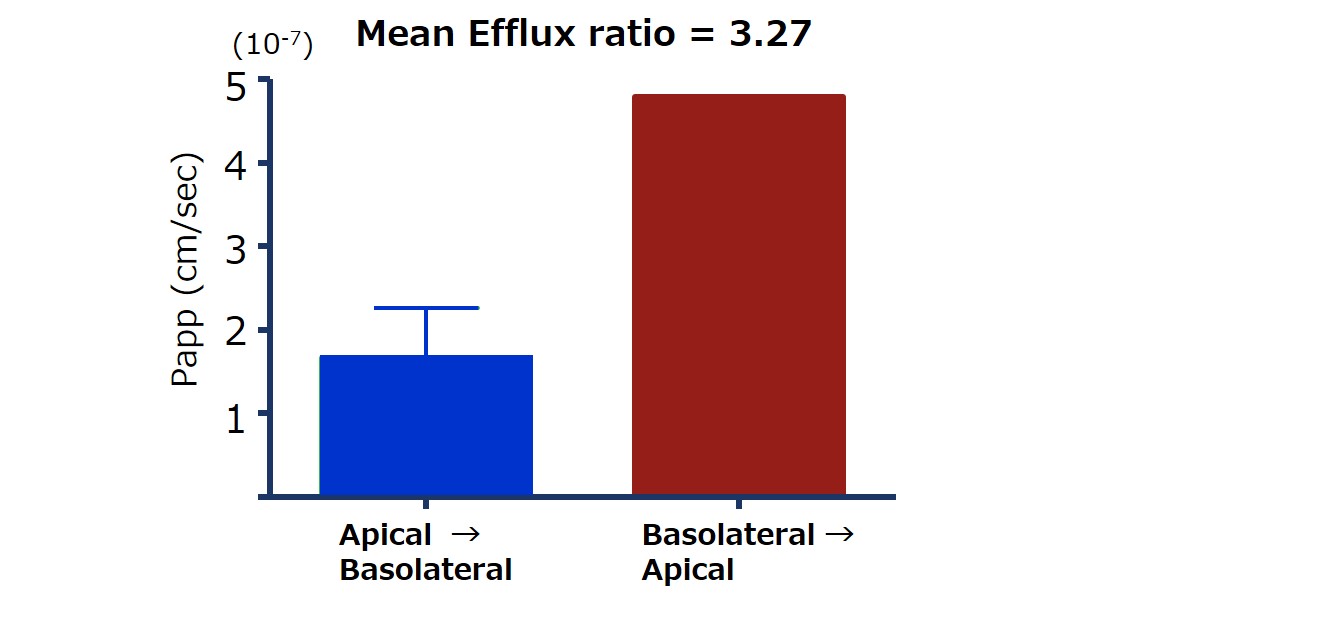
図11.P-gpを介したジゴキシンの排出データ
・皮膚
皮膚組織は、上述したような薬効評価だけでなく、薬物動態の観点からも使用されている。皮膚組織を用いた透過性および吸収性試験として、これまでに凍結された組織の使用が可能なフランツセルを用いた試験が実施されてきた。このような試験では単純な透過性や吸収性を評価するだけであったが、新鮮なヒト組織を利用することで、皮膚組織での代謝性も考慮した、より高度な評価が可能となる。図12で示したように、皮膚組織の表面に候補薬剤(青いクリーム)を添加して、その透過性を評価することができる。右図にあるように、表面上のクリームが内部に吸収されていく様子が観察され、組織内の候補薬剤の解析も可能である。
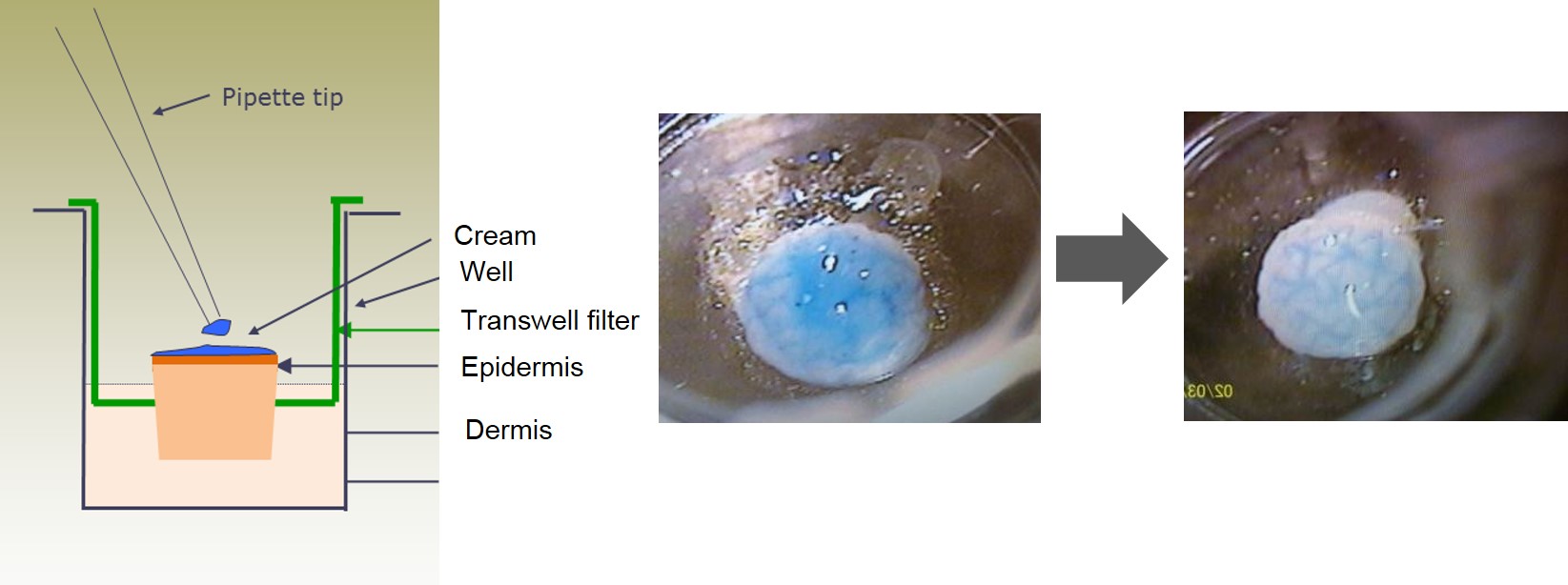
図12.皮膚組織への薬剤添加試験の模式図(左)と組織の様子(右)
(5) 安全性評価
治験でのドロップアウトの要因として、安全性・毒性での問題が大きな割合を占めている(1,3)。これは、実験動物から得られるデータだけでは限界があることを示しており、臨床試験に進む前に、ヒト組織を用いて得られるデータの重要性が増している。当社では、様々なヒト組織を用いてGLPに対応した安全性評価試験を実施しており、治験移行時の参考データとして使用データを提供している。
・循環器系(心臓・血管)
代表的な安全性試験として、心循環器に対する副作用を評価するために心臓・血管とOrgan Bath, Wire Myograph, Perfusion Myographが使用されている。Organ bathでは、柵状心組織の収縮・弛緩反応を評価し、Myographでは、血管での収縮・弛緩反応を評価する。柵状心組織を用いた例として、代表的な薬剤であるイソプレナリンとアセチルコリンによる収縮・弛緩のデータを図13に示す。心組織や血管の異常な反応は、心不全や血圧異常、頭痛等を引おこし、ヒトの安全性評価において、非常に重要な項目である。
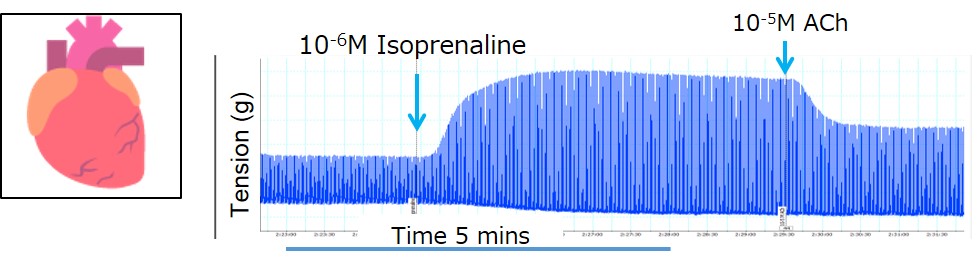
図13.柵状心室筋組織の収縮・弛緩反応
・呼吸器(気道・気管支・肺)
気道・気管支は、新組織や血管と同様にOrgan bathやWire Myographを用いた収縮・弛緩の評価試験に用いられる。両機器とも、筋組織を測定する一般的な装置であり、調製した筋組織の張力を測定することで、添加化合物の濃度依存的な反応を評価することができる。1例として、ヒト気管支でのアセチルコリンの濃度依存的な反応を示す(図14)。本例では、同一ドナーから得られた8個のサンプルの結果を表している。呼吸器においては、喘息やCOPD患者由来の組織を使用することで、疾患に対する安全性の評価も可能となる。
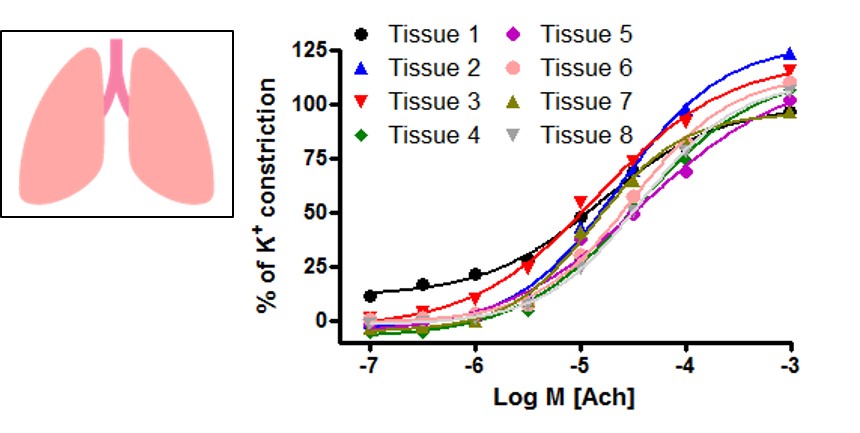
図14.アセチルコリンに対するヒト気管支の収縮反応
(6) 受託試験の流れ
(7) 対応試験例
薬効評価試験
|
番号
|
使用組織
|
機器・手法
|
評価項目
|
コントロール物質
|
対象事象
|
|---|---|---|---|---|---|
| RCBPEF001 | 腸(IBD患者由来) | Ex vivo culture | 組織学的変化 サイトカイン濃度 遺伝子発現 |
Steroid, MAPK inhibitor | 血便、 下痢、 腹痛 |
| RCBPEF002 | 皮膚(乾癬患者由来) | Ex vivo culture | 組織学的変化 サイトカイン濃度 遺伝子発現 |
LPS (Lipopolysaccharide), PHA (Phytohaemaggluttinin) | かゆみ |
| RCBPEF003 | 気管支(COPD患者由来) | Wire myograph | 収縮・弛緩 | Isoproterenol | 肺気腫、 気管支炎 |
| RCBPEF004 | 膀胱 | Organ bath | 収縮・弛緩 | Isoproterenol | 排尿障害 |
動態評価試験
|
番号
|
使用組織
|
機器・手法
|
評価項目
|
コントロール物質
|
対象事象
|
|---|---|---|---|---|---|
| RCBPAD001 | 腸(小腸、大腸) | Ussing chamber | 透過性 代謝性 |
Atenolol, Antipyrine, Sulfasalazine, Verapamil, Vinblastine, Isoproterenol, Cholera toxin | バイオアベイラビリティ |
| RCBPAD002 | 皮膚 | Ex vivo culture | 透過性 代謝性 |
クリーム、 ローション |
バイオアベイラビリティ |
安全性評価試験
|
番号
|
使用組織
|
機器・手法
|
評価項目
|
コントロール物質
|
対象事象
|
|---|---|---|---|---|---|
| RCBPSA001 | 心筋 | Organ bath | 収縮力 | 5-HT, Salbutamol, Milrinone | 心不全 |
| RCBPSA002 | 冠動脈 | Wire myograph | 収縮・弛緩 | 5-HT, Sumatriptan, Angiotensin II, Mephedrone, 8-arginine vasopressin | 心不全 |
| RCBPSA003 | 皮下抵抗動脈 | Wire myograph | 収縮・弛緩 | 5-HT, Phenylephrine, U46619, Acetylcholine, Bradykinin, SNP, Milrinone, Desmopressin | 血圧異常、 頭痛 |
| RCBPSA004 | 気管支 | Wire myograph | 収縮・弛緩 | VIP, Leukotriene D4, Acetylcholine, U46619, Isoproterenol, Salbutamol, Formoterol | 咳 |
| RCBPSA005 | 絨毛膜板動脈 | Wire myograph | 収縮・弛緩 | Bradykinin, Sildenafil | 胎児への影響 |
(8)発表論文
-
-
Moisan, A. et al. Mechanistic Investigations of Diarrhea Toxicity Induced by anti-HER2/3 Combination Therapy. Mol. Cancer Ther. 17, 1464-1474 (2018)
-
Miner, K. et al. The anthelmintic niclosamide is a potent TMEM16A antagonist that fully bronchodilates airways. bioRxiv.254888 (2018)
-
Lynch, J. J., Regan, C. P., Beatch, G. N., Gleim, G. W. & Morabito, C. J. Comparison of the intrinsic vasorelaxant and inotropic effects of the antiarrhythmic agents vernakalant and flecainide in human isolated vascular and cardiac tissues. J. Cardiovasc. Pharmacol. 61, 226–232 (2013)
-
Burke, S. K. et al. Recombinant human elastase alters the compliance of atherosclerotic tibial arteries after ex vivo angioplasty. J. Cardiovasc. Pharmacol. 67, 305–311 (2016)
-
Higgins, D. L. et al. The inability of tegaserod to affect platelet aggregation and coronary artery tone at supratherapeutic concentrations. Naunyn. Schmiedebergs. Arch. Pharmacol. 385, 103–109 (2012)
-
参考文献
-
Paul SM, Mytelka DS, Dunwiddie CT, Persinger CC, Munos BH, Lindborg SR, Schacht AL. How to improve R&D productivity: the pharmaceutical industry’s grand challenge. Nat Rev Drug Discov. 2010 Mar;9(3):203-14.
-
Sjöberg Å, Lutz M, Tannergren C, Wingolf C, Borde A, Ungell AL. Comprehensive study on regional human intestinal permeability and prediction of fraction absorbed of drugs using the Ussing chamber technique. Eur J Pharm Sci. 2013 Jan 23;48(1-2):166-80.
-
Kola I, Landis J. Can the pharmaceutical industry reduce attrition rates? Nat Rev Drug Discov. 2004 Aug;3(8):711-5.
 Global
Global
