米国FDA INDクリアランス取得|臨床グレード(臨床用)iPS細胞(日米欧規制対応)|再生医療
臨床グレード(臨床用)iPS細胞(StemRNA™ Clinical iPSC)の実績
米国FDA INDクリアランス取得(Gameto社:Fertilo)
2025年2月、当社が臨床グレードiPS細胞「StemRNA™ Clinical iPSC シードクローン」を供給している米国Gameto社.が、当該iPS細胞を用いた卵子の体外成熟技術「Fertilo」について、米国食品医薬品局(FDA)から第III相臨床試験のIND(治験届出)クリアランスを取得しました。これは、当社のiPS細胞を用いた治療法として米国で初めて臨床試験に進む見込みとなる画期的な成果であり、当社細胞の高い安全性と品質を改めて示すものです。
Gameto 社が今回取得した FDA IND クリアランスにより、同社は米国において、iPS 細胞を利用した治療法として初となる「Fertilo」の第 III 相臨床試験への移行を果たす見通しです。これにより、当社が長年にわたり培ってきた臨床 iPS 細胞技術の高い安全性と品質が、世界規模での再生医療・生殖医療の革新に貢献することが改めて実証されるものと考えております。
参考PDF:当社IR
CIRMとのパートナーシップ
2022年10月に世界最大規模の再生医療研究助成機関であるカリフォルニア州再生医療機構(CIRM)と基本合意書を締結し、CIRMのIndustry Alliance ProgramにIndustry Resource Partnerとして参画いたしました。
このパートナーシップにより、CIRMが資金提供する複数の重要な再生医療プロジェクトに対し、当社の高品質な臨床グレードiPS細胞「StemRNA™ Clinical iPSC シードクローン」を提供します。
CIRMとの連携は、当社の臨床グレードiPS細胞の品質と信頼性が国際的に高く評価されている証左です。当社は、この提携を通じて再生医療・細胞治療分野の研究開発をグローバルに加速させ、革新的な治療法の実現を目指す皆様を強力にサポートしています。
※カリフォルニア州再生医療機構(CIRM)について:CIRMは、カリフォルニア州の住民投票により設立された公的機構で、再生医療分野に関する高い知識と経験をもった専門家チームが、将来性があるとされる再生医療技術への研究開発、臨床応用への融資を行っています。
参考URL:https://www.cirm.ca.gov/
臨床グレード(臨床用)iPS細胞(StemRNA™ Clinical iPSC)の特長
1. 商業利用可能なインフォームドコンセント
IRBにて承認されたインフォームドコンセントに対して同意をいただいたドナーから組織採取をいたします。このインフォームドコンセントは、日米欧の要件を全てカバーしている商業利用・臨床利用が可能な内容となっています。
2. 日米欧の規格に準拠
日本(PMDA)・米国(FDA)・欧州(EMA)の規制要件を考慮したプロセスで開発・製造されています。
3. 厳格なドナースクリーニング
•PMDAとFDAとEMAから要求されるドナーに対する問診や感染症検査を実施しています。問診では、健康状態、既往歴、渡航歴等を含んでいます。感染症検査は、各規制当局により求められる条件(ウインドウピリオドや指定の試薬等)が異なりますので、それぞれに対応しています。
4. GMP準拠施設での製造
日本(神奈川県川崎市:特定細胞加工物製造許可(施設番号FA3200006))と米国(米国メリーランド州)の2拠点に再生医療用の細胞加工施設を完備しています。
殿町・リプロセル再生医療センター

メリーランド州GMP細胞加工施設

5. 高い安全性
iPS細胞樹立には、ゲノムへの挿入リスクがないmRNAを用いた「RNAリプログラミング法」を採用。導入遺伝子の残存リスクを最小限に抑え、高い安全性を確保しています。
※RNAリプログラミング法の優位性
mRNAを用いたRNAリプログラミング法は、再生医療・臨床研究で用いられるiPS細胞を樹立する手法として大きな優位性を有しています。
| 有意性 | 説明 |
|---|---|
| ゲノムへのインテグレーションリスクが小さい | 導入因子にmRNAを用いるので、ゲノム(DNA)には組み込まれない。 |
| 導入因子の残存性が低い | mRNAは、細胞内で速やかに分解される。 |
| 染色体の安定性が高い | 核型異常やコピー数多型(CNV)の頻度が従来法で樹立されたiPS細胞よりも小さい。(参照1, 2) |
| クローン間差が小さい | 未分化状態での遺伝子の発現のばらつきが小さい。(参照3) |
参照1.ゲノムの高い安定性
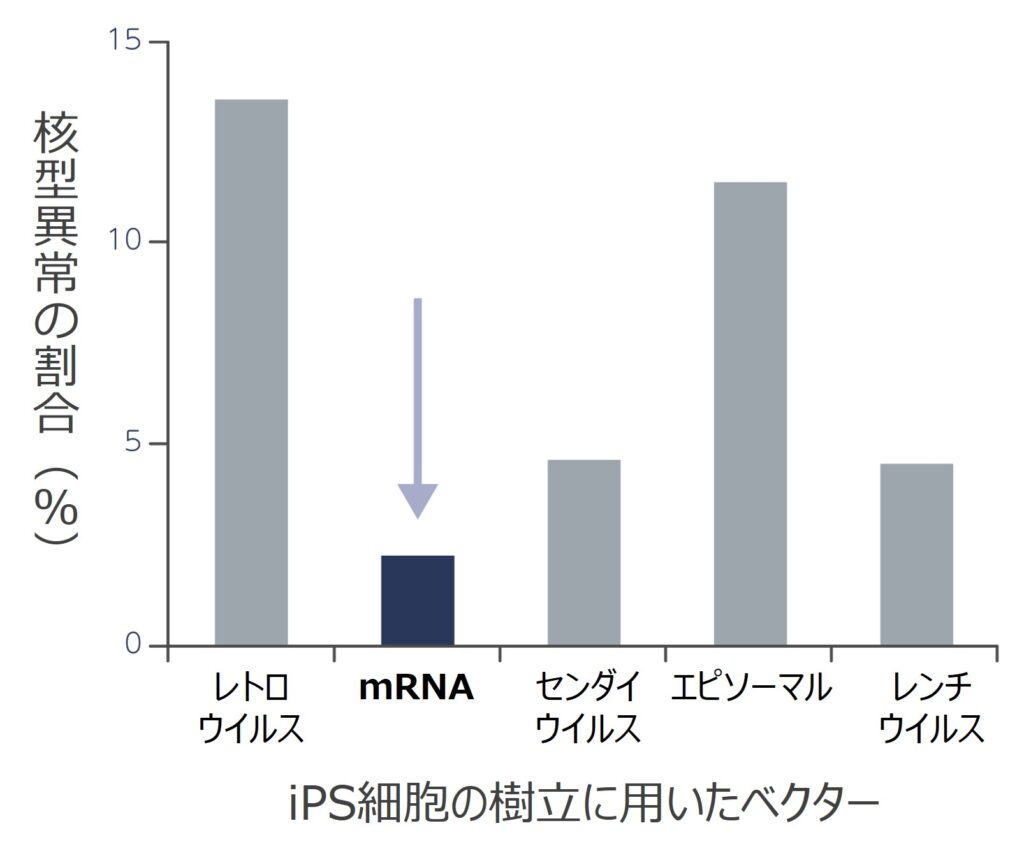
mRNAを用いたRNAリプログラミング法で樹立したiPS細胞は、その他の方法で樹立されたiPS細胞よりも核型異常の割合が小さいことが報告されている。
Schlaege T, et al., Nat Biotechnol. 2015 Jan 33(1): 58–63.より改変
参照2.少ないコピー数多型(CNV)
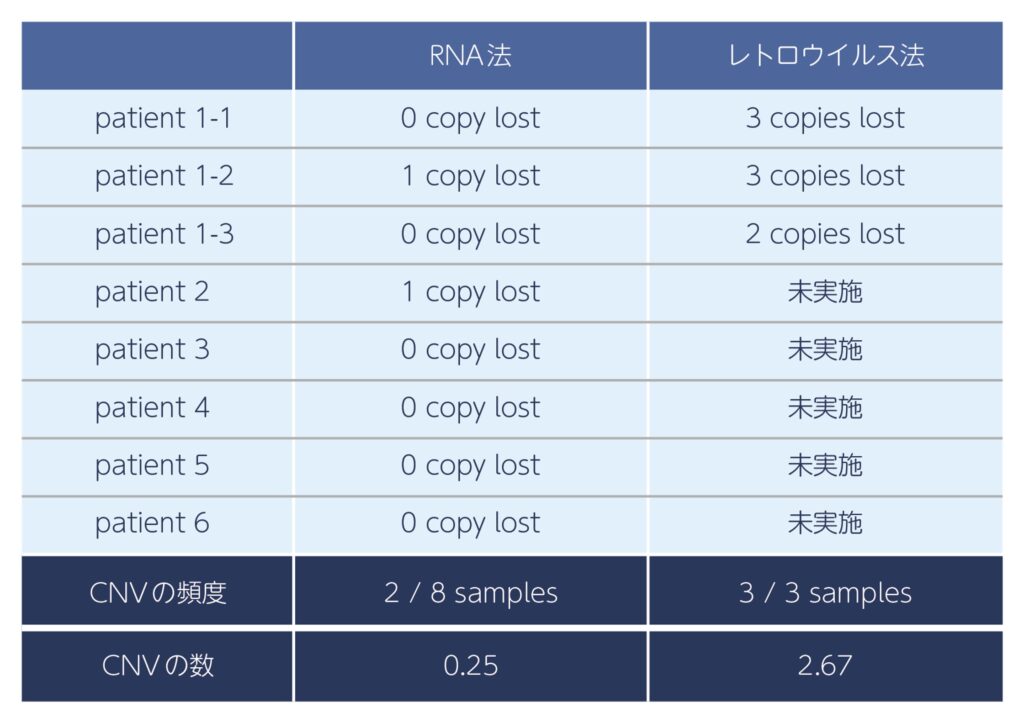
mRNAを用いたRNAリプログラミング法で樹立したiPS細胞は、コピー数多型の発生が抑えられていた。
Sarah E, et al., ISSCR 2015. より改変
参照3.小さなクローン間差
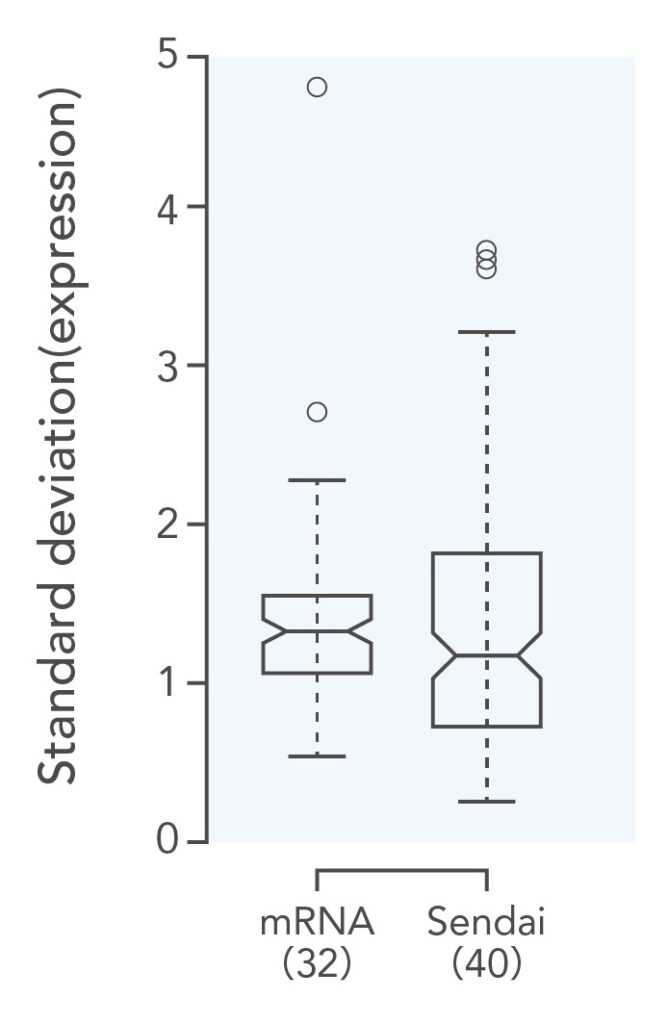
mRNAを用いたRNAリプログラミング法を用いて樹立したiPS細胞では、遺伝子発現のばらつきが小さくクローン間差が小さいことが報告されている。
Paull D, et al., Nat Methods. 2015 (9):885-92.より改変
iPS細胞は、2006年にマウス、2007年にはヒトにおいて樹立されが報告され、再生医療や創薬研究に革新をもたらしました。当初のiPS細胞樹立では、初期化因子をレトロウイルスベクターで線維芽細胞に導入し、細胞を初期化する方法が主流でした。
しかし、外来遺伝子の再活性化により腫瘍形成リスクがあることが報告され、ウイルスベクターの安全性が懸念されるようになります。特に、レトロウイルスやレンチウイルスのように染色体に遺伝子を組み込むベクターは、安全性の懸念から、使用が敬遠される傾向にあります。
このような背景を踏まえ、現在では安全性の高いiPS細胞の樹立方法が求められており、以下の3点が重要視されています。
再生医療分野で使用されるiPS細胞は、これらの条件を満たすために多数のクローンから慎重に選別され、臨床試験に供されました。
iPS細胞樹立に用いられているベクターとしては、エピゾーマルベクターとセンダイウイルスベクターがありますが、それぞれに課題があります。エピゾーマルベクターは染色体への組み込みリスクを完全には排除できず、センダイウイルスベクターはゲノムに取り込まれない一方で、導入因子が長期間残存することが報告されています。
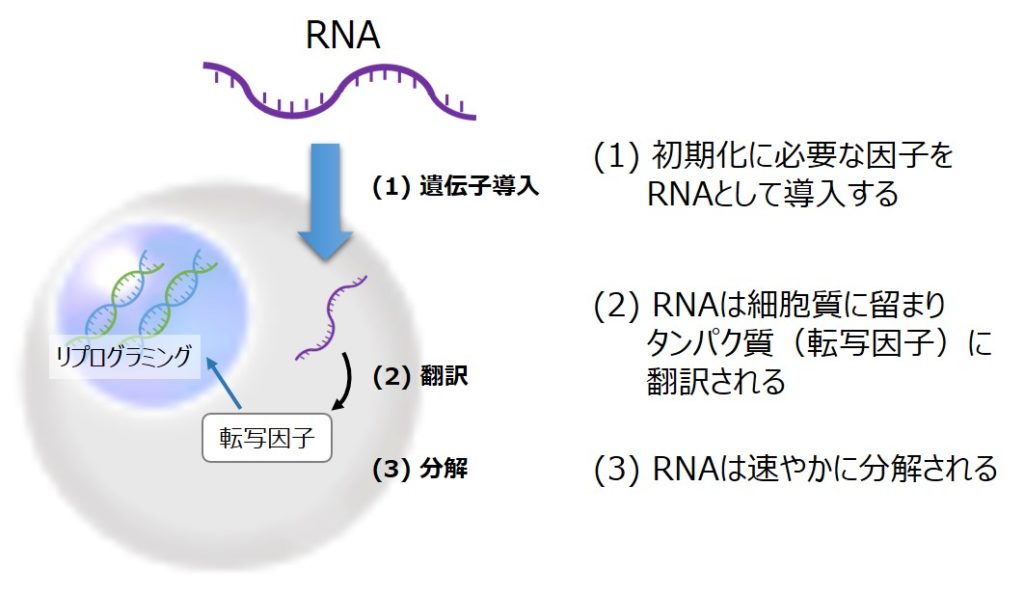
このような課題を解決する新たな方法として注目されているのが、RNAリプログラミング法です。この方法では、mRNAを導入因子として細胞に加えることで、染色体への影響を回避しながら効率よく初期化を実現します。mRNAは細胞質内で翻訳された後、速やかに分解されるため、残存性が極めて低く、染色体への影響も最小限です(下図参照)。
RNAリプログラミング法で樹立されたRNA-iPS細胞は、導入因子が細胞に残らず、染色体構造も安定しており、クローン間差も小さいことから、再生医療において理想的な細胞とされています。
臨床グレード(臨床用)iPS細胞(StemRNA™ Clinical iPSC)の概要
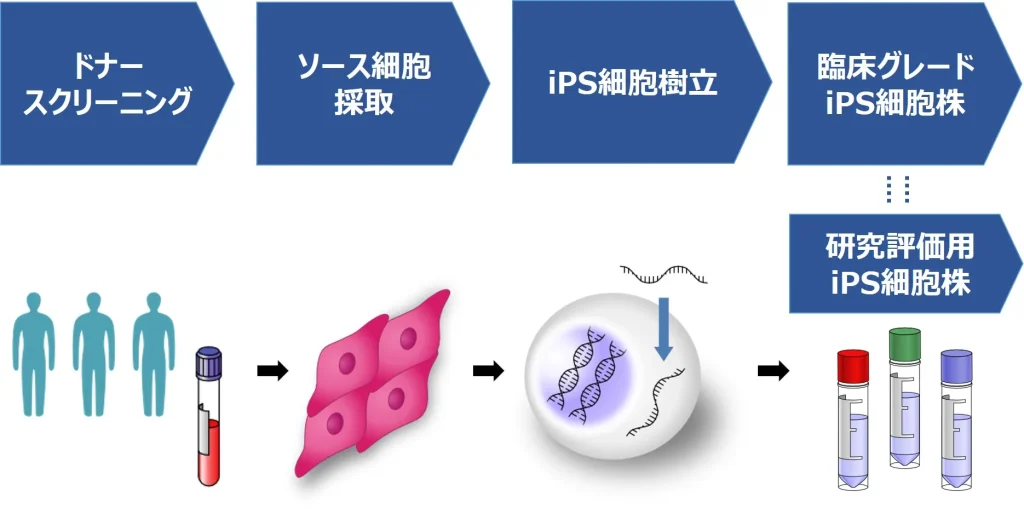
リプロセルは、日本、米国、欧州の3拠点にあるグループ会社のノウハウを活用し、PMDA(日本)およびFDA(米国)/EMA(欧州)とのコンサルテーションを通じて、各国(日本、米国、欧州)の規制に対応した臨床グレードiPS細胞を提供しています。適切なドナースクリーニングを行い、得られたソース細胞から、RNAリプログラミング法を用いて、臨床グレードiPS細胞を作製しました。現在は、複数のドナーから複数のiPS細胞株を作製し、臨床グレードiPS細胞株と、それらのiPS細胞株の選定のため、同一クローンを研究用途用に拡大培養した研究評価用のiPS細胞株を提供しています。
臨床グレードシードクローンラインアップ
| クローン名 | ドナー名 | 性別 | 年齢 | 血液型 | 人種 | 由来組織 |
| VCT-37-F26 | RPC-VCT-37 | 女性 | 23歳 | A(+) | Caucasian | 線維芽細胞 |
| VCT-37-F35 | ||||||
| VCT-37-F36 | ||||||
| LLF-34-FTM03 | RPC-LLF-34 | 女性 | 22歳 | O(+) | Caucasian | 線維芽細胞 |
| XTF-45-FTM19 | RPC-XTF-45 | 男性 | 27歳 | A(+) | Caucasian | 線維芽細胞 |
| XTF-45-FTM21 | ||||||
| XTF-45-FTM27 | ||||||
| SKH-44-F07 | RPC-SKH-44 | 男性 | 23 歳 | A(+) | Caucasian | 線維芽細胞 |
| SKH-44-F11 | ||||||
| SKH-44-F19 |
研究評価用パイロットクローンラインアップ
研究評価用iPS細胞株は、臨床グレードiPS細胞株を研究グレードの条件で拡大培養後に凍結しています。そのため、研究評価用iPS細胞株は、臨床iPS細胞株と同等の特長を有しており、臨床iPS細胞株を使用する前に、使用目的に最適な株の選定のため(例えば目的細胞への分化傾向の評価など)に、使用いただけます。
| 品番 | 品名 | クローン名 | 希望小売価格 |
| P-VCT-37-F26 | StemRNATM Clinical iPSC Pilot Clone (VCT-37-F26) | VCT-37-F26 | お問い合わせ下さい |
| P-VCT-37-F35 | StemRNATM Clinical iPSC Pilot Clone (VCT-37-F35) | VCT-37-F35 | お問い合わせ下さい |
| P-VCT-37-F36 | StemRNATM Clinical iPSC Pilot Clone (VCT-37-F36) | VCT-37-F36 | お問い合わせ下さい |
| P-LLF-34-FTM03 | StemRNATM Clinical iPSC Pilot Clone (LLF-34-FTM03) | LLF-34-FTM03 | お問い合わせ下さい |
| P-XTX-45-FTM19 | StemRNATM Clinical iPSC Pilot Clone (XTX-45-FTM19) | XTX-45-FTM19 | お問い合わせ下さい |
| P-XTX-45-FTM21 | StemRNATM Clinical iPSC Pilot Clone (XTX-45-FTM21) | XTX-45-FTM21 | お問い合わせ下さい |
| P-XTX-45-FTM27 | StemRNATM Clinical iPSC Pilot Clone (XTX-45-FTM27) | XTX-45-FTM27 | お問い合わせ下さい |
| P-SKH-44-F07 | StemRNATM Clinical iPSC Pilot Clone (SKH-44-F07) | SKH-44-F07 | お問い合わせ下さい |
| P-SKH-44-F11 | StemRNATM Clinical iPSC Pilot Clone (SKH-44-F11) | SKH-44-F11 | お問い合わせ下さい |
| P-SKH-44-F19 | StemRNATM Clinical iPSC Pilot Clone (SKH-44-F19) | SKH-44-F19 | お問い合わせ下さい |
臨床グレード(臨床用)iPS細胞(StemRNA™ Clinical iPSC)の未分化評価
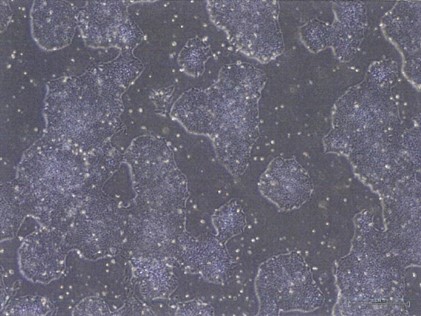
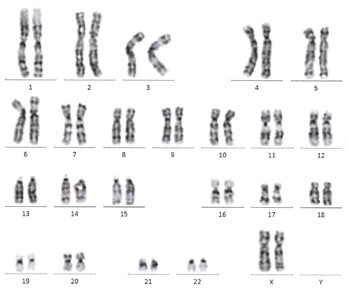
RNAリプログラミング法で作製されたiPS細胞は、ゲノムへのインテグレーションが起こらず、安全なiPS細胞が得られると知られています。iPS細胞の形態、核型、未分化マーカーの発現等、正常性が確認できています。(記載データは全てVCT-37-F35株)
明視野像と6継代後のG-バンド染色像(右図)
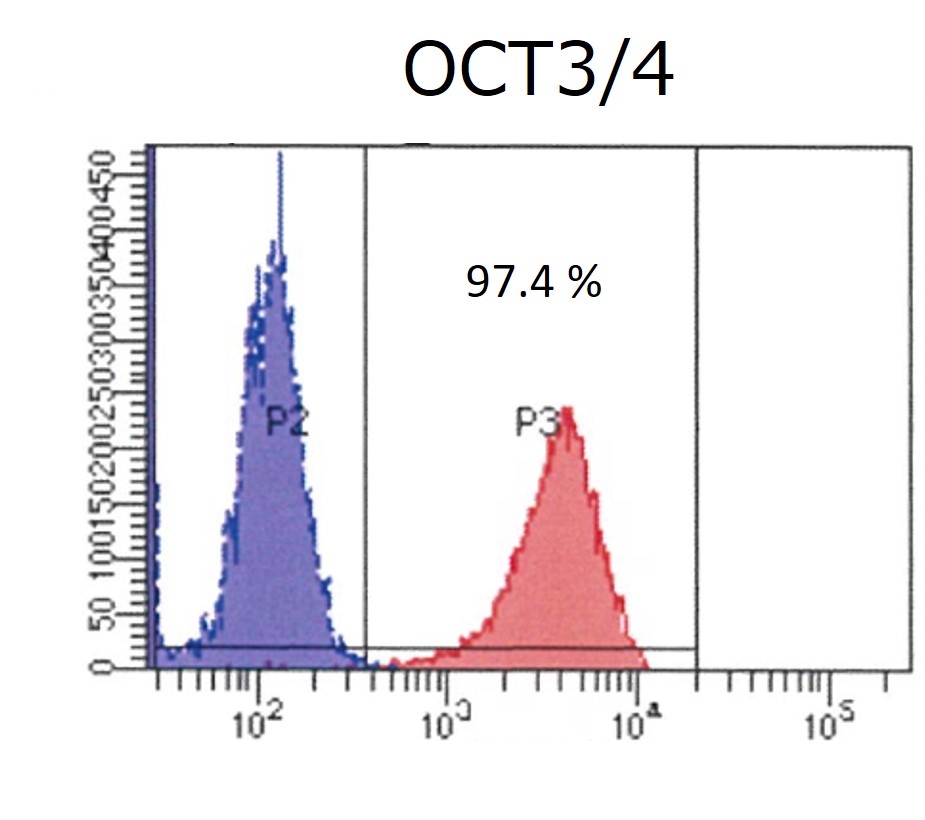
臨床グレードiPS細胞株(VCT-37-F35株)の未分化マーカー(OCT3/4、SSEA-4)の発現量を評価しました。どちらのマーカーも97%以上の細胞で発現がみられ、未分化状態を維持していることが示されました。

臨床グレード(臨床用)iPS細胞(StemRNA™ Clinical iPSC)の分化能
三胚葉への分化能(遺伝子発現)
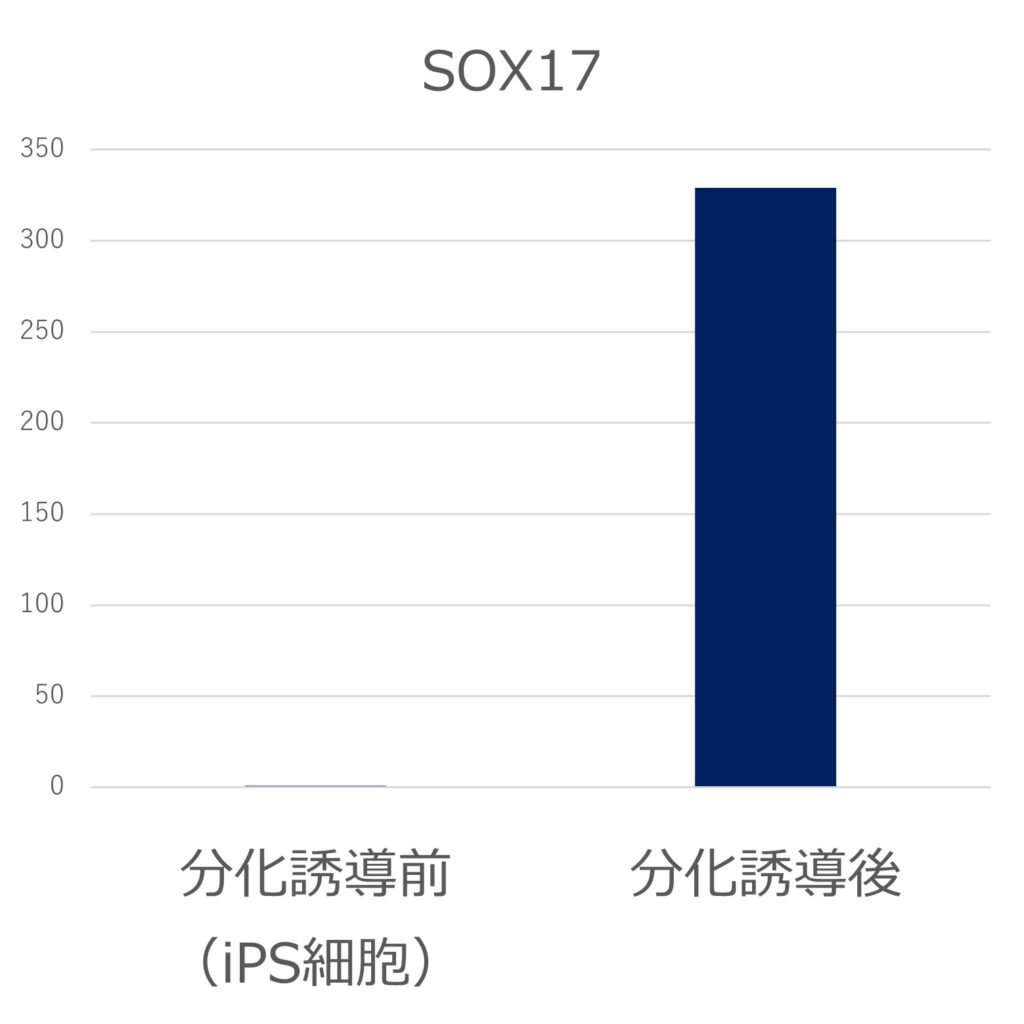
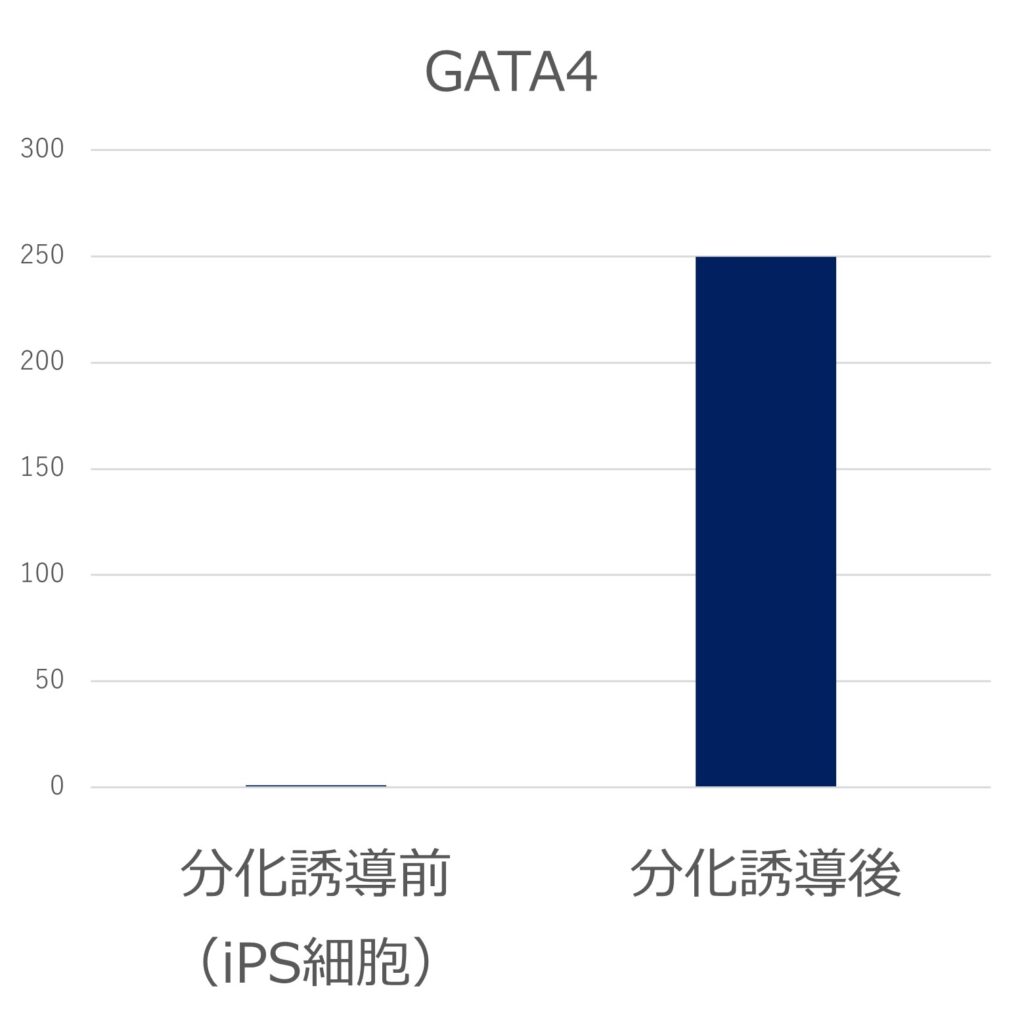
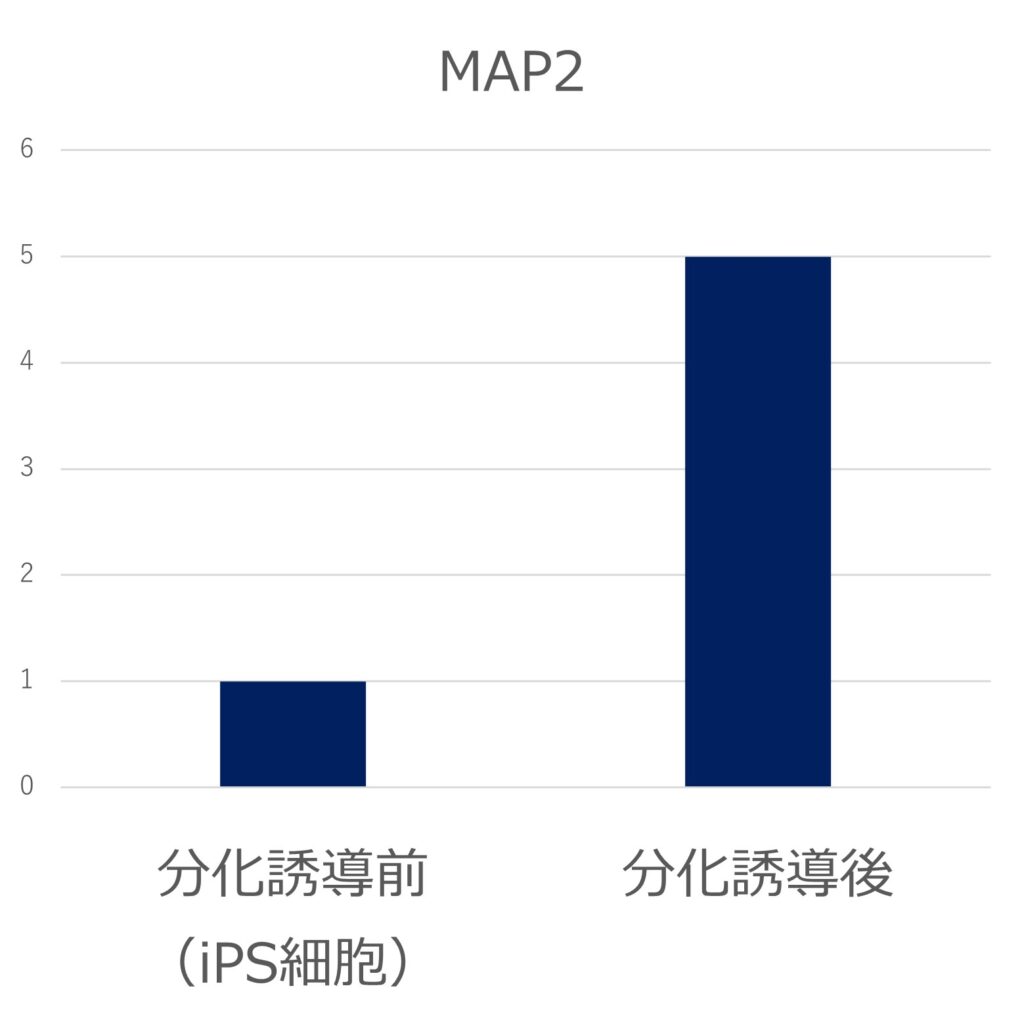
臨床iPS細胞株(VCT-37-F35株)を三胚葉にそれぞれ分化誘導し、各胚葉のマーカー遺伝子(内胚葉:SOX17、FOXA2、中胚葉:GATA4、Brachyury、外胚葉:PAX6、MAP2)の発現をPCRで評価しました。それぞれのマーカー遺伝子の発現が誘導され、三胚葉への分化能を有することが示されました。(未分化iPS細胞の発現を1とする)
●内胚葉(SOX17、FOXA2)

●中胚葉(GATA4、Brachyury)

●外胚葉(PAX6、MAP2)

神経系細胞
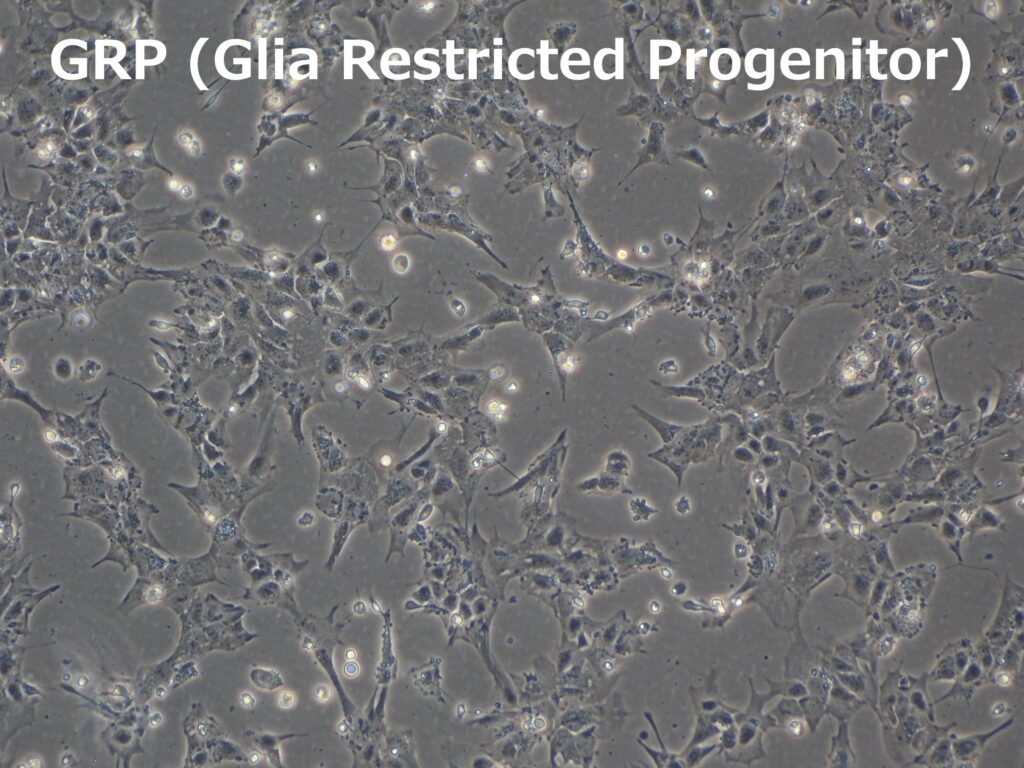
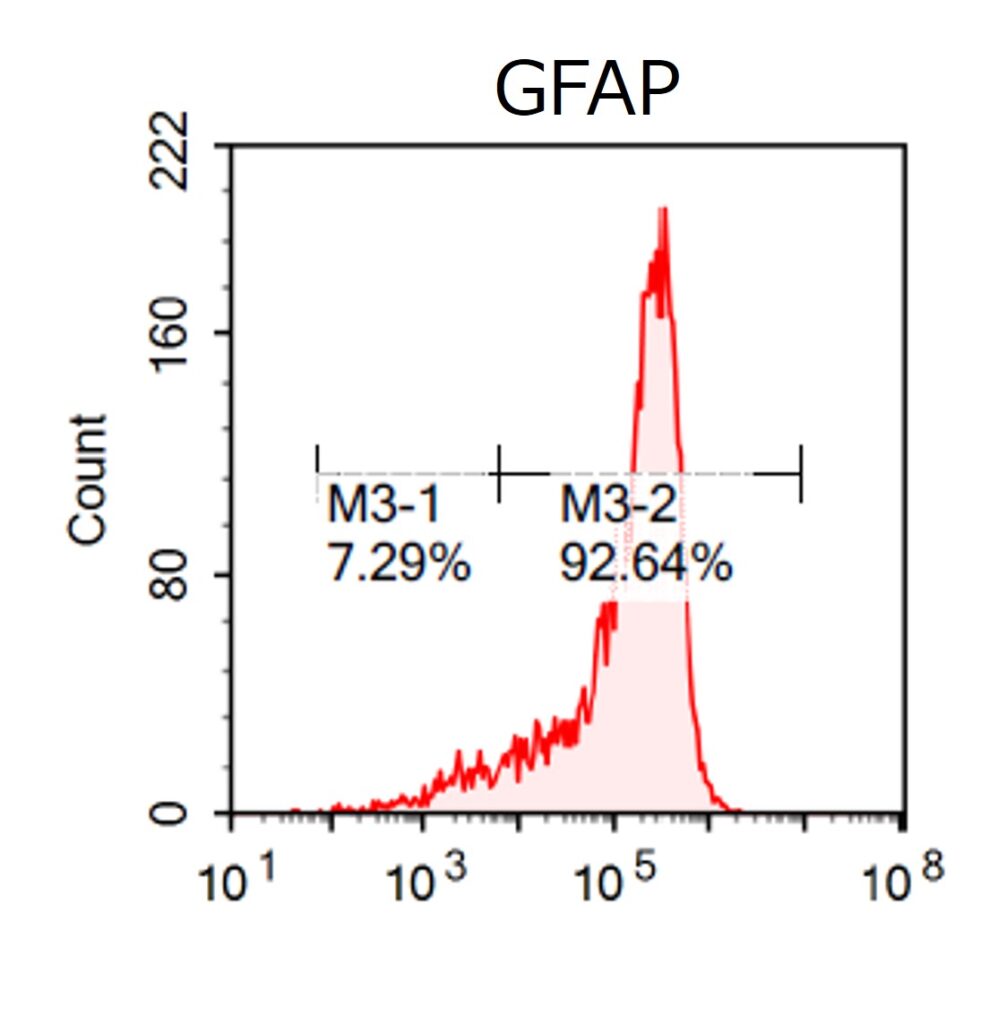
臨床グレードiPS細胞(VCT-37-F35株)から、神経幹細胞への分化誘導を行いました。神経幹細胞マーカーであるPAX6、SOX1の発現が確認できています。さらに、これらのiPS細胞から、アストロサイトへの分化誘導を行い、90%以上の細胞がGFAP陽性のアストロサイトへと分化しました。
●神経幹細胞への分化誘導(PAX6、SOX1の発現)


●GRP・アストロサイトへの分化(明視野顕微鏡像、GFAPの発現)
造血系細胞
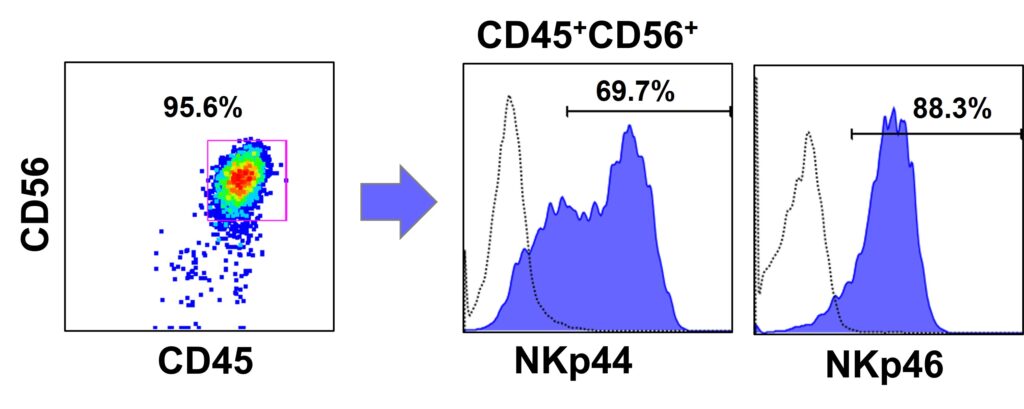
臨床グレードiPS細胞(VCT-37-F35株)から、造血幹細胞へと分化誘導しました。造血幹細胞マーカーである(CD34、CD43)の両遺伝子の発現を確認しました。さらにNK細胞へ分化誘導を行い、NK細胞の特徴(CD45陽性、CD56 陽性、CD3陰性)を有する細胞が得られました。その他のマーカーとして、NKp44 (CD336)、NKp46 (CD335)陽性細胞が得られました。さらに、K562細胞との共培養実験において、NK細胞の細胞障害活性が確認できました。
※下記のデータは全て東京都医学総合研究所 原孝彦先生からご提供いただきました。
●造血幹細胞への分化誘導(CD34、CD45)
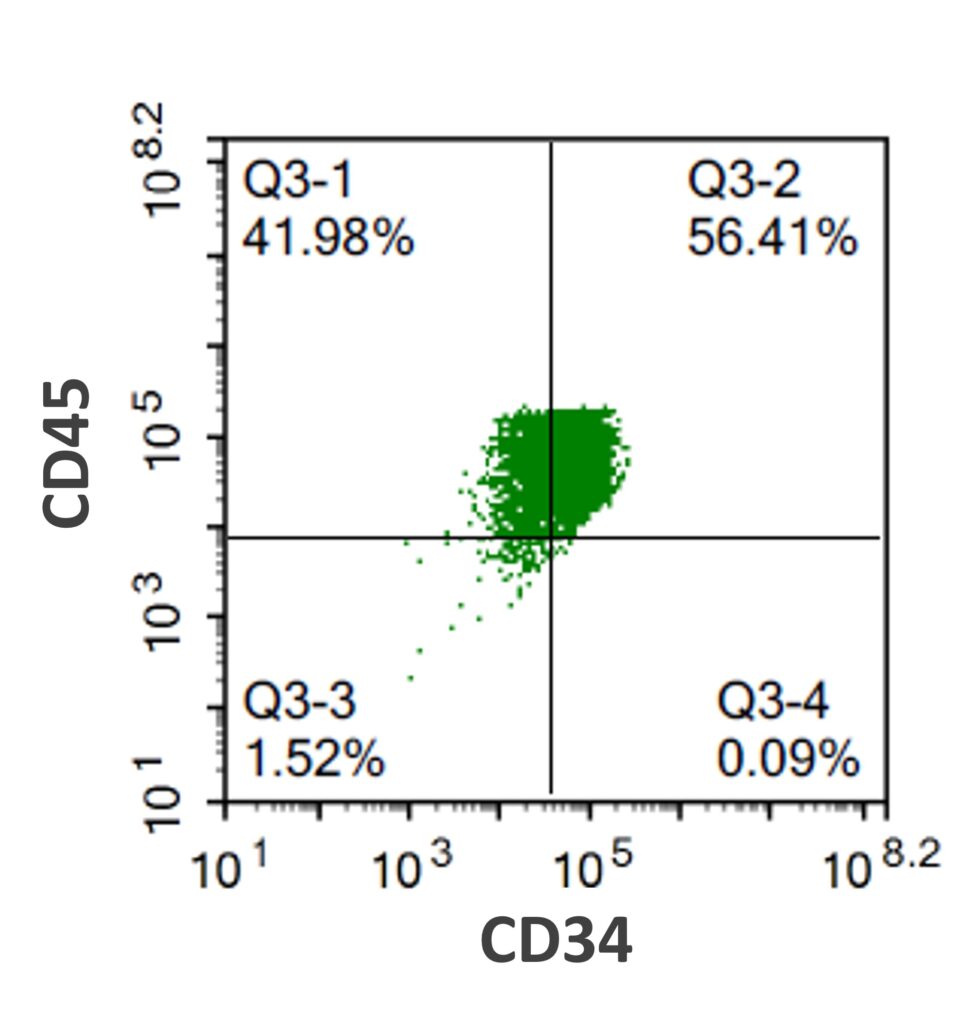
造血幹細胞
●NK細胞への分化誘導(CD45、CD56、CD3)

●NK細胞への分化誘導(NKp44、NKp46)
●NK細胞の細胞障害活性(タイムラプス画像)
分化誘導したNK細胞の細胞障害活性を評価するために、生細胞染色試薬CFSEで標識したヒト慢性骨髄性白血病細胞株K562細胞と分化誘導したNK細胞との共培養を行いました。
10,000個のNK細胞と1,000個のK562細胞を96ウェルプレートに播種し、ライブイメージング観察を行いました。NK細胞は、分化誘導37日目の細胞をソーティングせずに用いました。
緑色の丸い細胞がK562細胞であり、細長い細胞がNK細胞であり、分化誘導したNK細胞の障害活性が確認できました。
撮影時間は80分間。
 Global
Global
