筋萎縮性側索硬化症(ALS)/横断性脊髄炎(TM)に対する細胞医療
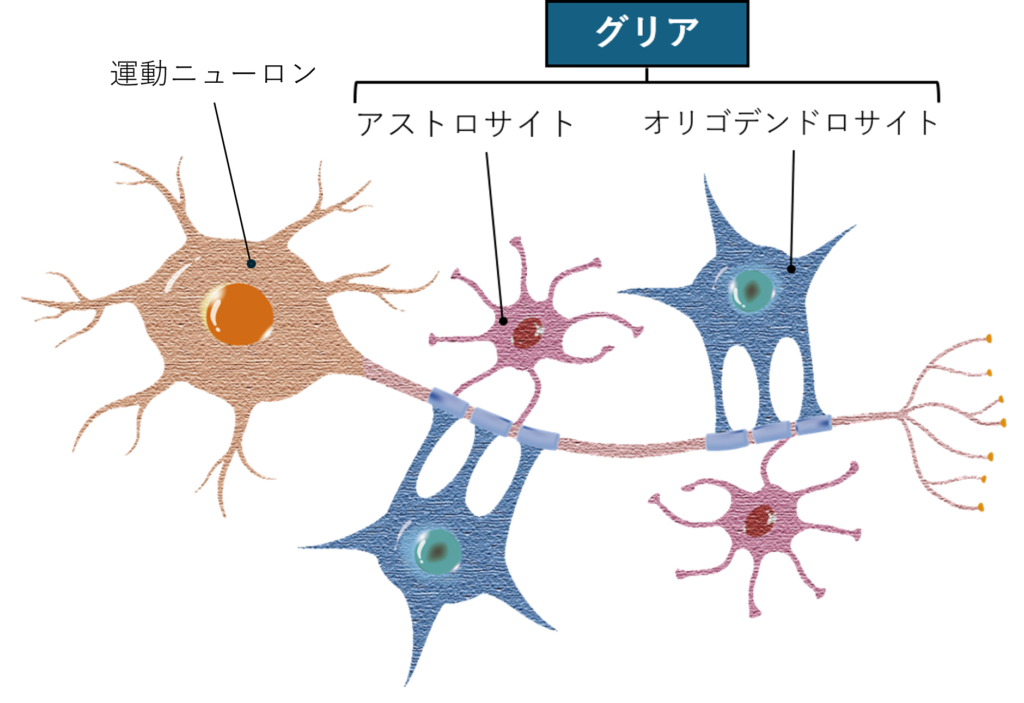
iPS神経グリア細胞 (iGRP)
リプロセルは、中枢神経系疾患に対する新たな治療戦略の取り組みとして、iPS細胞から神経グリア前駆細胞(iGRP:glial-restricted progenitor cells)を作製し、臨床応用を目指す研究開発を進めています。
これまで、米国Q Therapeutics Inc. が開発した胎児組織由来の神経グリア前駆細胞GRP(Q-Cell®)、非臨床試験で様々な中枢神経疾患に対する有効性を示しており、米国において筋萎縮性側索硬化症(ALS)および横断性脊髄炎(TM)を対象疾患とした治験計画届(IND)のFDAによる審査を完了しています。しかしながら、原料細胞として胎児組織を使用していることから、神経グリア前駆細胞の安定供給と倫理上の課題がありました。
そこで、リプロセルでは原料細胞を胎児組織からiPS細胞に置き換えることより、原料供給や倫理上の問題をクリアし、安定的に大量の神経グリア前駆細胞(iGRP)を製造することが可能になりました。
【治療イメージ】

適格性が認められたドナーからiPS細胞を樹立します。

iPS細胞を分化誘導し、グリア細胞の前駆体であるiGRPを作ります。

iGRPを移植することで運動ニューロンが活性化され、運動機能改善が期待されます。
iPS神経グリア細胞(iGRP)
iPS神経グリア細胞(iGRP)は、iPS細胞から、アストロサイトやオリゴデンドロサイトへの分化能を有する神経グリア前駆細胞へと分化誘導された再生医療製品です。
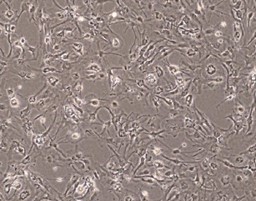
①組織採取
ガイドラインに基づく組織採取
- ウイルス検査などドナー適格性の確認
②iPS細胞の樹立
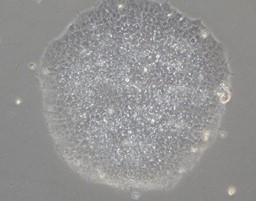
RNAリプログラミングによるiPS樹立
- リプログラミング因子の残存なし
- ガン化リスク低減
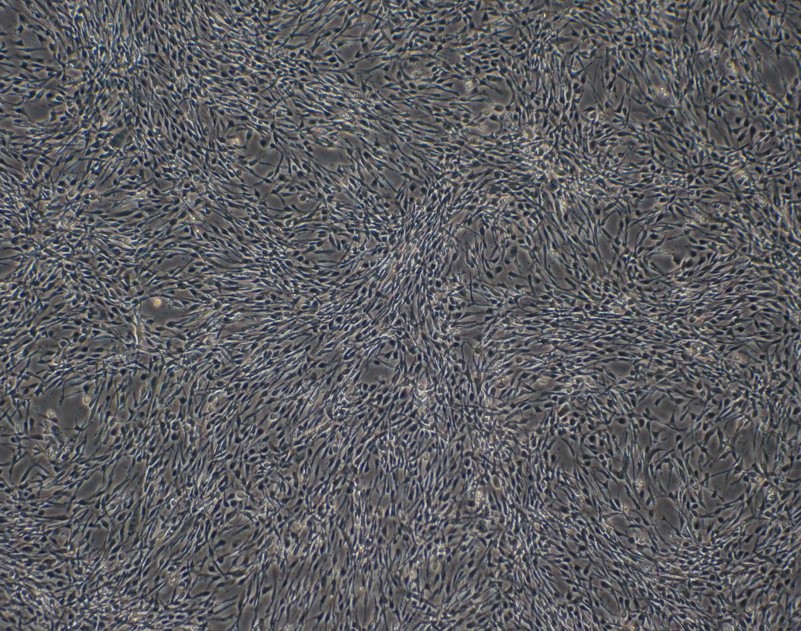
③神経グリア細胞
神経グリア細胞への分化誘導
- 高効率
- 高純度
作用機序
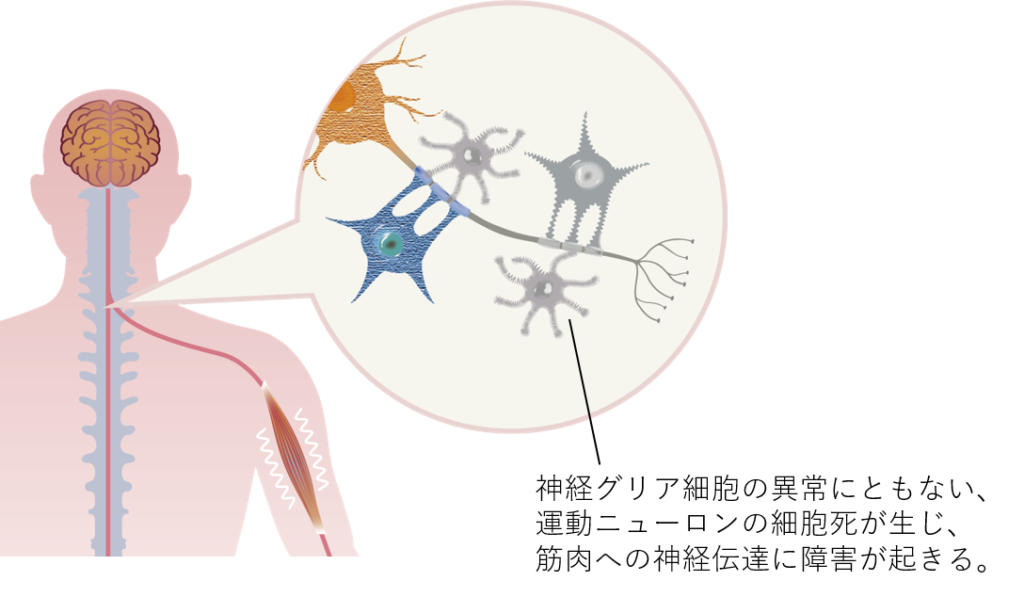
筋萎縮性側索硬化症(ALS)や横断性脊髄炎の病態として、運動ニューロンの支持細胞である神経グリア細胞における異常が、運動ニューロンの細胞死を引き起こすことが明らかとなってきています。人工多能性幹細胞(iPS細胞)から誘導されるiPS神経グリア前駆細胞(iGRP)には、成長因子の供給、毒素除去、及び免疫反応の調整などを通じて、ALSや横断性脊髄炎における運動ニューロンの細胞死を抑制し、その機能を保護する役割があると考えられています。
適応疾患
筋萎縮性側索硬化症(ALS)【指定難病2】
筋萎縮性側索硬化症(ALS)とは、上位および下位運動ニューロンの変性を特徴とする神経変性疾患です。筋萎縮や筋力低下の進行により、呼吸補助なしでの生存期間は2~4年と言われています1)。
日本における患者数はおよそ1万人であり、毎年1,000~2,000人が新たに診断されています。50~74歳の年齢層の男性に多く発症すると言われています。
ALSの病態について全容は解明されていませんが、運動ニューロンの変性には、アストロサイトやオリゴデンドロサイトといったグリア細胞が深く関係していることが分かっています2)。
現在承認されている医薬品の臨床における治療効果は極めて限定的であり、さらなる治療法の開発が求められています。

- Mejzini R, et al. ALS Genetics, Mechanisms, and Therapeutics: Where Are We Now? Front Neurosci. 2019 Dec 6;13:1310. PMID: 31866818
- Haidet-Phillips AM, et al. Human glial progenitor engraftment and gene expression is independent of the ALS environment. Exp Neurol. 2015 Feb;264:188-99. Epub 2014 Dec 16. PMID: 25523812
横断性脊髄炎(TM)
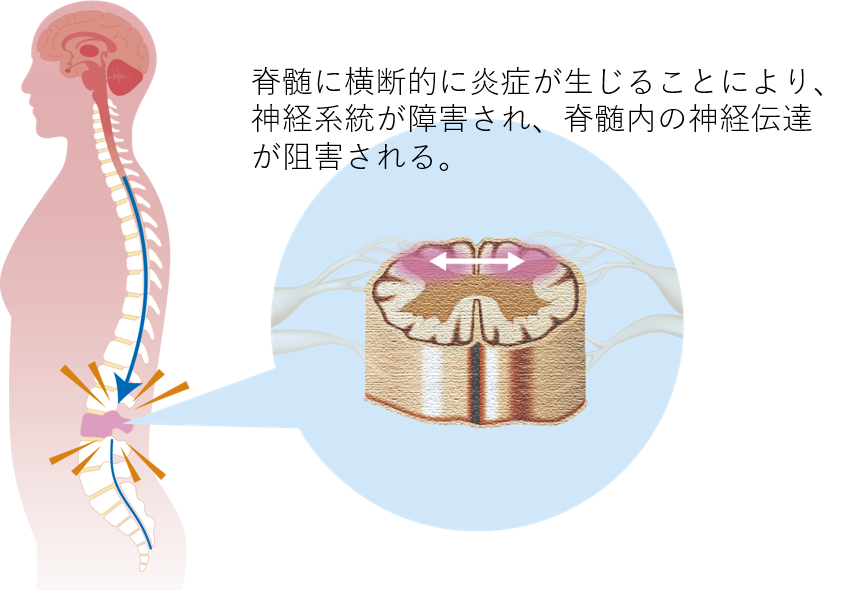
横断性脊髄炎 (TM) は後天性の局所炎症性疾患で、急激な筋力低下、感覚障害、排便・排尿障害を引き起こすことが多い疾患です。通常は独立して発生しますが、感染症の合併症として発生することも多く、他の神経炎症性疾患の連続体の一部として存在することもあります。病状は脊髄を横断し、両側に障害を引き起こします。ただし、部分的または非対称的な影響のみである場合もあります。
罹病期間は3~6か月と短い場合もあれば、永久に衰弱する場合もあります。障害が最大になると、患者の50%が完全に下半身麻痺となり、ほぼすべての患者がある程度の膀胱や腸の機能不全を患います3) 。
TMの発症には自己免疫が関わっていると考えられることから、現在は免疫抑制剤やステロイドの投与が一般的な治療方法となっています。また、それらの治療を行っても症状が悪化する場合、自身の血液を取り出し健康なドナーの血漿を入れて置き換える、血漿交換療法を行うこともあります。しかし、これらの治療効果は未だ不明であり、さらなる効果的な治療法の開発が求められています。
- Simone CG, et al. Transverse Myelitis. 2022 Nov 15. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan–. PMID: 32644728.
Q-Cell®の非臨床試験の結果から、GRPは以下の様々な中枢神経系疾患への有効性が期待されます。
- 脱髄性疾患:筋萎縮性側索硬化症(ALS)、横断性脊髄炎(TM)、脳性麻痺、脳梗塞、多発性硬化症
- 神経変性疾患:ハンチントン病、脊髄損傷、外傷性脳損傷、パーキンソン病、アルツハイマー病
リプロセルは、希少疾患であるALSや横断性脊髄炎をターゲットとした開発へ優先的に着手し、その後ターゲットとなる疾患を広めていきます。
♦GRPターゲット疾患の米国におけるデータ

開発状況

2018年10月、テキサス大学において、TMを対象疾患とした胎児組織由来GRP(Q-Cell®)の治験計画がアナウンスされました。この治験では、重症型のTM患者9人へQ-Cell®を投与し、安全性と有効性を評価する計画です。
また、疾患モデル動物試験ではGRPの投与を受けた疾患モデルマウスの生存日数が延長され、ミエリン形成が観察されました。
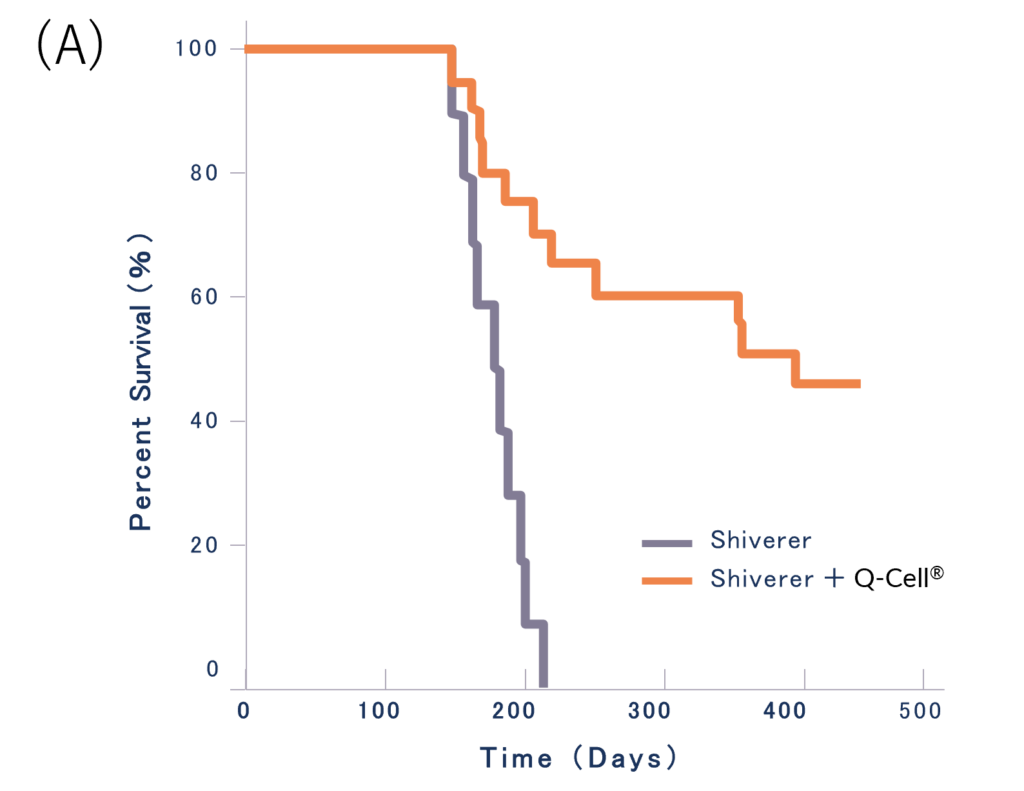
(A)疾患モデルマウス(Shiverer :黒線)と比較して、ヒトグリア前駆細胞GRP(Q-Cell®)を投与した疾患モデルマウス(Shiverer + Q-Cell® :橙線)の生存日数が延長しました4)。
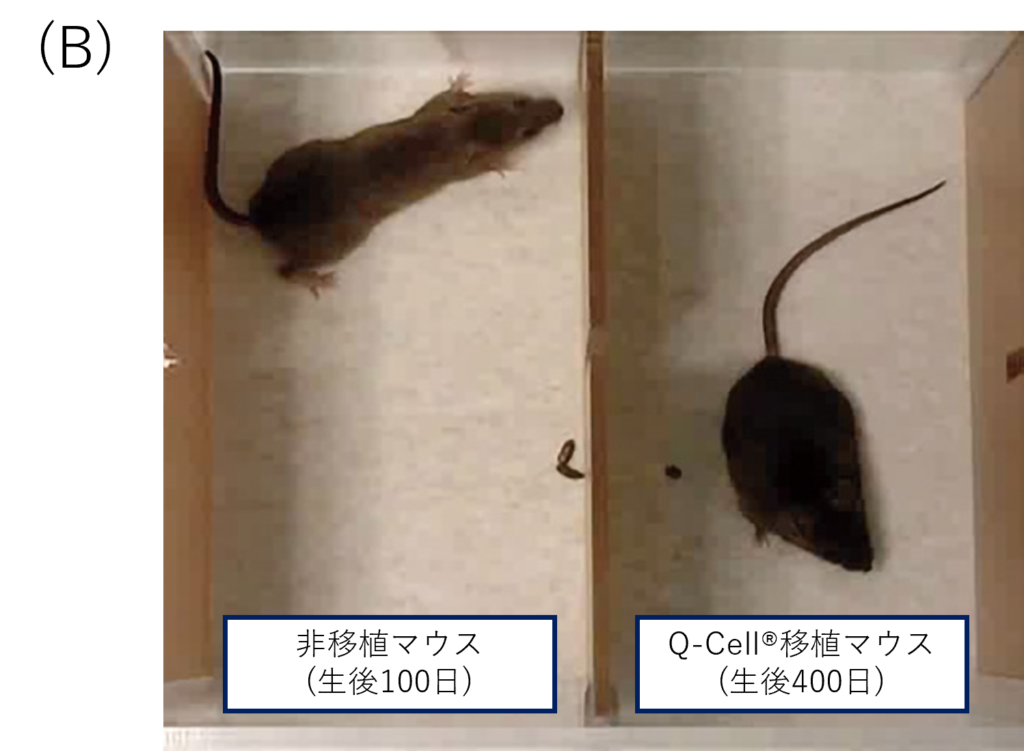
(B)髄鞘欠損モデルマウスの様子です。非移植マウスに比べ、Q-Cell®移植マウスでは運動機能が残存しています。
- Lyczek A, et al. Transplanted human glial-restricted progenitors can rescue the survival of dysmyelinated mice independent of the production of mature, compact myelin. Exp Neurol. 2017 May;291:74-86. Epub 2017 Feb 2. PMID: 28163160.
リプロセルでは、iPS細胞から神経グリア細胞を作製し、各種神経変性疾患に対するiPS細胞再生医療製品として研究開発を行っています。現在、iPS神経グリア細胞を用いた前臨床試験(動物試験)を実施しています。
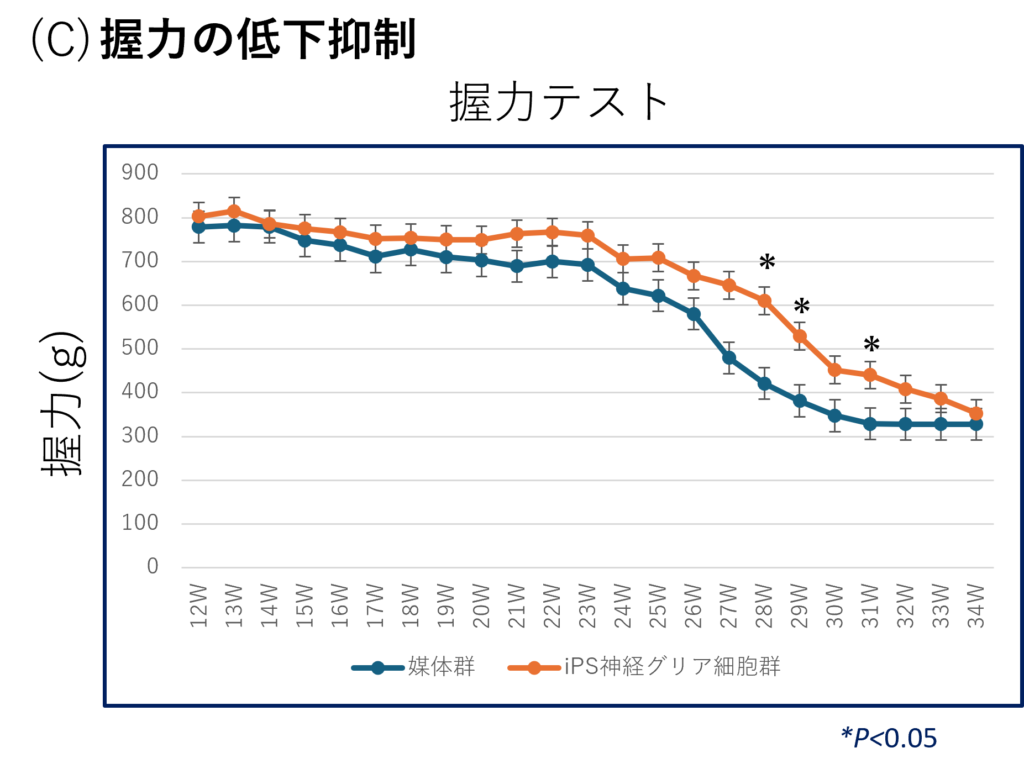
(C) ALSモデルラットにおいて、iGRPを投与した群は28、29、31週目でプラセボ群に対し、有意に高い握力を示しました(*p<0.05) 。
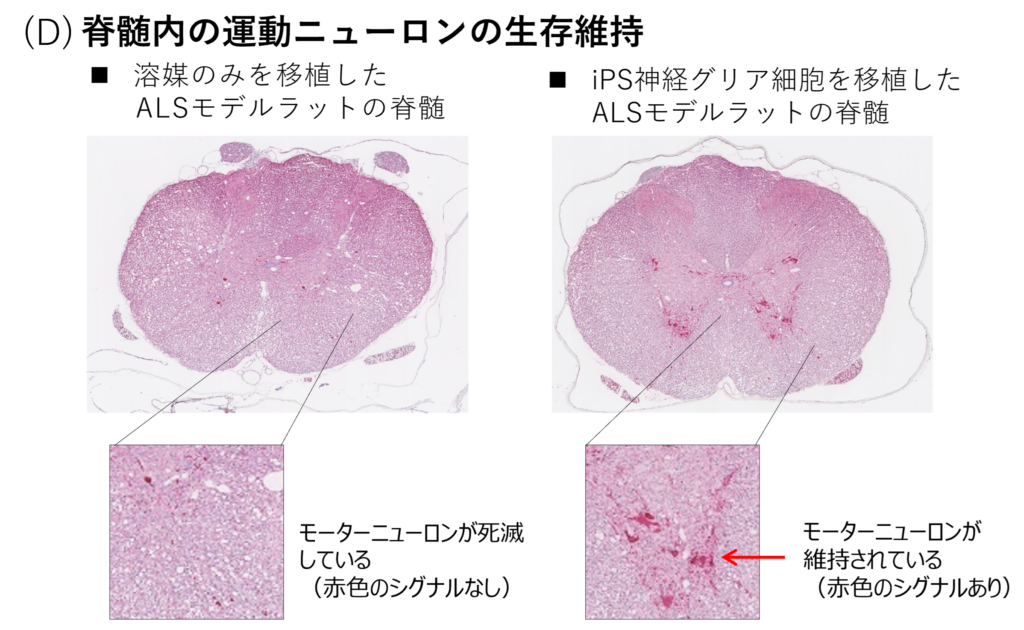
(D) ALSモデルラットに対し、モーターニューロンを赤色に染めるChAT染色を行いました。脊髄内の前角部において、媒体投与群に比べ、iGRPを投与した群ではモーターニューロンが多く残存しています。
疾患モデル動物試験の詳細についてはこちら。
2022年10月には、AMED 公募事業「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業」に採択されました。本事業の支援により、研究開発を加速させ一日も早い臨床試験の開始を目指しています。
 Global
Global
