
iPS細胞 再生医療等製品受託サービス
再生医療等製品受託サービス概要

リプロセルは、日本、米国、欧州の3拠点にあるグループ会社のノウハウを活用して、各国の規制(日本(PMDA)、米国(FDA)、欧州(EMA))に対応した再生医療等製品を一貫して受託製造します。iPS細胞由来の再生医療等製品の製造では、ドナーの探索から分化細胞の製造まで、多くの工程が必要となりますが、リプロセルでは、下記のすべてのプロセスを規制対応した基準で実施します。
(1)RNAリプログラミング法を用いたiPS細胞のシードストック
(2)CRISPR/Cas9によるゲノム編集
(3)マスターセルバンクの作製
(4)再生医療等製品の製造
(1) 再生医療用iPS細胞のシードストック
リプロセルが提供する再生医療用iPS細胞は、倫理的な観点と安全性の観点において、日・米・欧の規制に従ったプロセスで得られた細胞から樹立されています。商用利用にも対応したインフォームドコンセントを用いていて、ウイルス試験等の安全性においても十分な検査を実施しています。
 | 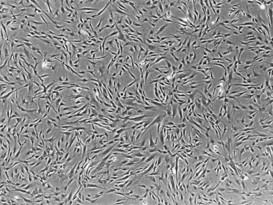 | 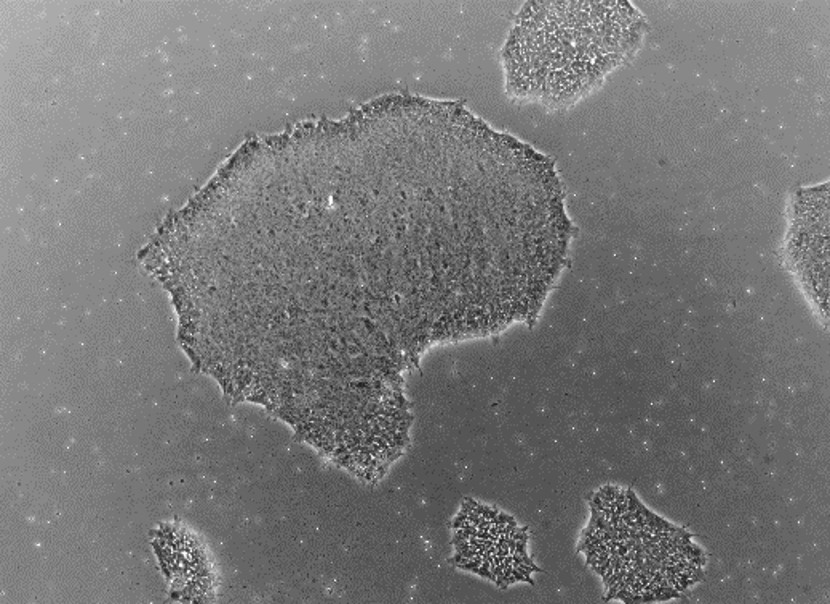 |
| 線維芽細胞 | iPS細胞 |
iPS細胞の樹立には、mRNA法を使用しています。mRNA法では、初期化因子をmRNAとして導入するので、導入遺伝子のゲノムへのインテグレーションが起こりません。さらにmRNAは細胞内での残存性が低いため、本手法では安全性が高いiPS細胞が得られます。これらの特徴により、mRNA法は臨床用iPS細胞の樹立方法として最適と考えています。mRNA法の説明は(こちら)。また、再生医療用iPS細胞の樹立、培養は、各種規制(USP<1043>や生物由来原料基準など)に対応した試薬を用いて行います。
このようなプロセスで樹立された再生医療用のiPS細胞を既に樹立しており、提供が可能な複数のiPS細胞株をシードストックとして保有しています。これらのシードストックの中から、テスト用のiPS細胞株をご使用いただき、用途に適した株を選定していただきます。また、個々の要望に合わせて新たにドナーを探索して、iPS細胞のソース検体を取得することも可能です。
現在提供可能な臨床用iPS細胞株
| 樹立方法 | 由来細胞 | ドナー情報 | その他 |
|---|---|---|---|
| mRNA法 | 線維芽細胞 | 性別:女性 人種:Caucasian 年齢:23歳 | 同一ドナー由来の4株を樹立 |
| mRNA法 | 線維芽細胞 | 性別:女性 人種:Caucasian 年齢:22歳 | 同一ドナー由来の5株を樹立 |
(2) CRISPR/Cas9によるゲノム編集(オプション)
リプロセルは、2018年よりGenAhead社と協業でCRISP/CAS9技術を用いたゲノム編集サービスを実施しています。これまでに、疾患モデル細胞の作製やレポーター遺伝子の挿入など、iPS細胞に対して多くの実績を有しています。特にSNP置換や、ホモ株・ヘテロ株の作り分けといった高度なゲノム編集を得意としています。
再生医療で移植される細胞や組織は、レシピエントとHLAの型が一致しないと、移植後に免疫細胞に攻撃され、排除されてしまいます。そこで、移植時の免疫拒絶反応を抑えることを目的として、ユニバーサル細胞と呼ばれるiPS細胞の作製が、遺伝子編集技術を活用して進められています。例えば、B2M(β2ミクログロブリン)とCIITA(ClassII Tansactivator)の両遺伝子がターゲットとして、考えられています。リプロセルは、これらの両遺伝子をダブルノックアウトしたiPS細胞の作製実績を有します。このダブルノックアウト細胞の作製は、まず、B2M遺伝子のノックアウト(ホモ)株を作製し、さらに、CIITA遺伝子のノックアウト(ホモ)を行い、B2M/CIITAのダブルノックアウト株を作製しました(下図)。
概要

HLA(Class I & II)の発現抑制
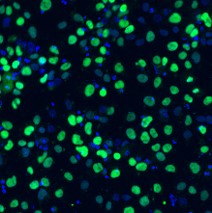
B2M遺伝子とCIITA遺伝子をダブルノックアウトしたiPS細胞株で、HLAの発現量をフローサイトメトリーで測定しました。Class I の発現は、iPS細胞での発現量を親株と比較しました(左図:抗HLA-ABC抗体使用)。Class IIの発現は、分化後の細胞で発現制御が起こるため、iPS細胞から分化誘導したマクロファージで比較しています(右図:抗HLA-DR抗体使用)。どちらのClassのHLAもB2M/CIITAノックアウト株では、発現が抑えられています。これらの結果から、免疫拒絶反応を抑えることを目的としたiPS細胞の作製が、ゲノム編集技術によって可能であることが示されました。
その他の遺伝子編集も実施いたしますので、ご要望がありましたら、お問い合わせ下さい。

※東京都医学総合研究所 原孝彦先生からご提供
(3) マスターセルバンクの作製
樹立した複数のiPS細胞株またはゲノム編集を行った複数のiPS細胞株の中から、最適なiPS細胞株を選んでいただき、200本~400本程度のマスターセルバンクを作製します。マスターセルバンクに保管されるiPS細胞は、対象となる規制「ICH Q5A/D」に則り、日・米・欧の規制に対応した品質評価試験を実施します。これらのすべての工程は、マスターセルバンク作製の実績があるFDA、EMAの認証を受けた海外CDMOと協業の上で実施します。
 |  |
(4) 再生医療等製品(分化細胞)の製造
クライアントが保有している分化誘導方法を元にして、日・米・欧の規制に対応した施設・プロセスで、再生医療等製品を製造します。分化誘導プロトコールが再生医療等製品の製造に適していなかった場合は、再生医療等製品の製造に対応できる培地や手法に置き換え、分化誘導方法の最適化を実施します。このように最適化されたプロトコールを用いて、GMP施設を有する外部CDMOにて、再生医療等製品を製造します。
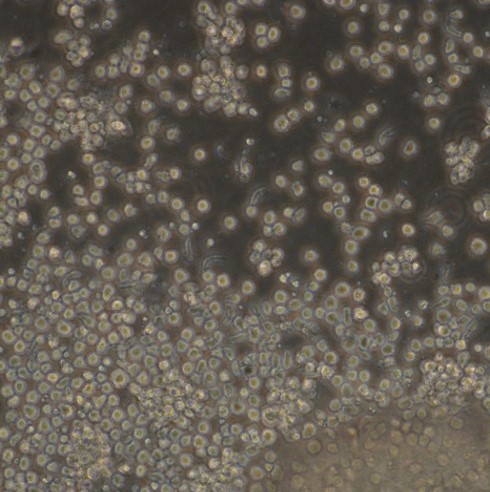
リプロセルは、iPS細胞由来の肝細胞、神経細胞、小腸上皮細胞、血球細胞、心筋細胞等、これまで様々な細胞種への分化誘導技術(こちら)を開発してきた実績があります。
iPS細胞由来分化細胞の例
| 神経細胞 | 肝細胞 | 造血前駆細胞 | 小腸上皮細胞 | グリア細胞 |
 |  |  |  |  |
 Global
Global
